
科目: 来源:2016届浙江省富阳市高三上学期第二次质检化学试卷(解析版) 题型:填空题
某结晶水合物A含有两种阳离子和一种阴离子。将溶有90.60gA的水溶液分成两等份,向第一份逐滴加入NaOH溶液,溶液先出现白色沉淀后完全溶解,此过程中产生2.24 L(标准状况)刺激性气味的气体。向第二份加入过量的Ba(OH)2溶液,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.60 g。
请回答以下问题:
(1)A的摩尔质量为 。
(2)试通过计算确定该结晶水合物的化学式为 。
(3)若第二份加入75.00 mL2.00 mol·L-1的Ba(OH)2溶液,则得到的沉淀质量为 。
查看答案和解析>>
科目: 来源:2016届云南省昆明市高三上学期10月摸底调研测试理综化学试卷(解析版) 题型:选择题
下列说法错误的是
A.金属钠着火可用干燥沙土扑灭
B.地沟油经处理后可用作生物柴油
C.糖类、油脂、蛋白质均为高分子化合物
D.氢氧化铁胶体的分散质粒子能通过滤纸孔隙
查看答案和解析>>
科目: 来源:2016届云南省昆明市高三上学期10月摸底调研测试理综化学试卷(解析版) 题型:选择题
反应中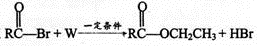 ,W为
,W为
A.CH3CHO B.CH3CH2OH
C.CH3COOH D.H2O
查看答案和解析>>
科目: 来源:2016届云南省昆明市高三上学期10月摸底调研测试理综化学试卷(解析版) 题型:选择题
短周期元素甲、乙、丙、丁的原子半径依次增大,其氢化物中甲、乙、丙、丁的化合价如右表所示。下列说法中正确的是

A.元素非金属性:甲<乙
B.含氧酸的酸性:乙<丁
C.氢化物的沸点:甲>丁
D.丙所形成的单质可能互为同位素
查看答案和解析>>
科目: 来源:2016届云南省昆明市高三上学期10月摸底调研测试理综化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数的值。下列叙述正确的是
A.常温下,44g CO2中含有2NA个碳氧双键
B.标准状况下,0.1mol Al3+含有的核外电子数为0.3NA
C.室温下,1L pH=13的氢氧化钡溶液所含氢氧根离子数为0.2NA
D.将1mol N2和3mol H2通入密闭容器中,在一定条件下充分反应,转移电子数为6NA
查看答案和解析>>
科目: 来源:2016届云南省昆明市高三上学期10月摸底调研测试理综化学试卷(解析版) 题型:选择题
莽草酸结构简式如右图。下列说法错误的是
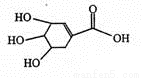
A.该物质分子式为C7H10O5
B.该物质与乙酸互为同系物
C.该物质能与乙醇发生酯化反应
D.1 mol该物质与Na反应时,最多消耗Na4 mol
查看答案和解析>>
科目: 来源:2016届云南省昆明市高三上学期10月摸底调研测试理综化学试卷(解析版) 题型:选择题
有关煤的综合利用如图所示。下列说法正确的是

A.煤和水煤气均是二次能源
B.煤中含有苯、甲苯、二甲苯等有机物
C.①是将煤在空气中加强热使其分解的过程
D.B为甲醇或乙酸时,原子利用率均达到100%
查看答案和解析>>
科目: 来源:2016届云南省昆明市高三上学期10月摸底调研测试理综化学试卷(解析版) 题型:填空题
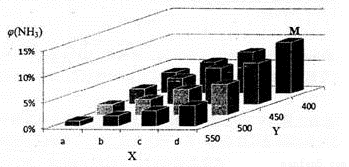
1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g) 2NH3(g)△H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如下图所示。
2NH3(g)△H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如下图所示。
回答下列问题:
(1)已知: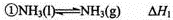 ,
, ,则反应N2(g)+3H2(g)
,则反应N2(g)+3H2(g) 2NH3(g)的△H= (用含△H1、△H2的代数式表示)。
2NH3(g)的△H= (用含△H1、△H2的代数式表示)。
(2)合成氢的平衡常数表达式为____ ,平衡时,M点NH3的体积分数为10%,则N2的转化率为____ (保留两位有效数字)。
(3)X轴上a点的数值比b点 (填“大”或“小”)。上图中,Y轴表示 (填“温度”或“压强”),判断的理由是 。
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如下表所示:

下列判断正确的是_____________。
A.放出热量:Ql< Q2< △Hl B. N2的转化率:I> III
C.平衡常数:II >I D.达平衡时氨气的体积分数:I>II
(5)常温下,向VmL amoI.L-l的稀硫酸溶液中滴加等体积bmol.L-l 的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)______________c(SO42-)(填“>”、“<”或“=”)。
(6)利用氨气设计一种环保燃料电池,一极通入空气,另一极通入氧气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式_ _________。
查看答案和解析>>
科目: 来源:2016届云南省昆明市高三上学期10月摸底调研测试理综化学试卷(解析版) 题型:实验题
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行以下探究活动:
【探究一】
(1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________________。
(2)另取铁钉放入一定量浓硫酸中加热,充分反应后得到溶液X并收集到干燥气体Y。
①甲同学认为X中可能含有Fe3+和Fe2+。若要确认其中的Fe2+,应选用__________(填序号)。
a.KSCN溶液 b.铁氰化钾溶液 c.盐酸
②乙同学取448mL(标准状况)气体Y通入足量溴水中,发生反应的离子方程式为___ _,充分反应后,加入足量BaC12溶液,经适当操作后得干燥固体2.33g。可推知气体Y中SO2的体积分数为__________。
【探究二】
据探究一所测SO2的体积分数,丙同学认为气体Y中可能还含有CO2和Q气体,因此设计了下列实验装置(图中夹持仪器省略,实验前已将装置中空气排尽)进一步探究。
(3)装置A中的现象是 ,其作用是________________。

(4)为判断CO2是否存在,需将装置M添加在______________(填序号);
a.A之前 b.A~B之间 c.B-C之间 d.C~D之间
若存在CO2,则产生CO2气体的反应中氧化剂与还原剂的物质的量之比为__________。
(5)若C中固体变红,D中固体变蓝,则Q是___________(填化学式),产生该气体的原因是__________。
(6)若某气体可能由CO2、SO2、H2中的一种或多种组成,经测定其中氧的质量分数为50%,则该气体的组成可能为__________(填序号)。
a.SO2 b.H2、SO2 c.H2、 CO2 d.CO2、SO2 e.CO2、SO2、H2
查看答案和解析>>
科目: 来源:2016届云南省昆明市高三上学期10月摸底调研测试理综化学试卷(解析版) 题型:填空题
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
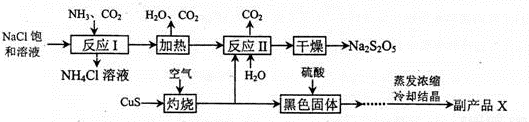
已知:反应II包含2NaHSO3=Na2S2O5+ H2O等多步反应。
(1)反应I的总化学方程式为 ,反应I进行时应先通入的气体是 ,反应I产生的NH4Cl可用作________________。
(2)灼烧时发生反应的化学方程式为 ,若灼烧时生成SO21.12×l06 L(标准状况下),则转移电子____ mol。
(3)己知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为_______________。
(4)副产品X的化学式是 ________________,在上述流程中可循环使用的物质是___________________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应II中气体与固体的物质的量之比约为 ,检验产品中含有碳酸钠杂质所需试剂________________。(填编号)。
①澄清石灰水 ②饱和碳酸氢钠溶液 ③氢氧化钠
④酸性高锰酸钾 ⑤稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com