
科目: 来源:期末题 题型:填空题

查看答案和解析>>
科目: 来源:浙江省月考题 题型:填空题

 CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=________(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=________(填计算结果)。 2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。
2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。 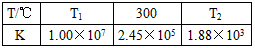
查看答案和解析>>
科目: 来源:陕西省模拟题 题型:填空题

查看答案和解析>>
科目: 来源:山东省模拟题 题型:填空题
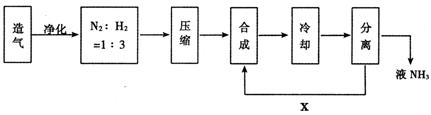
查看答案和解析>>
科目: 来源:吉林省期中题 题型:填空题
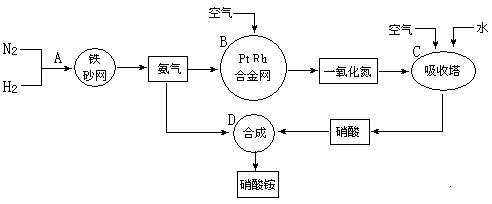
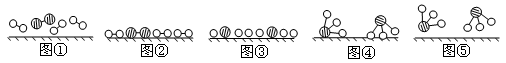
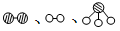 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是__________________、__________________。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是__________________、__________________。  7N2+12H2O(NO 也有类似的反应)
7N2+12H2O(NO 也有类似的反应)
查看答案和解析>>
科目: 来源:重庆市期中题 题型:填空题

查看答案和解析>>
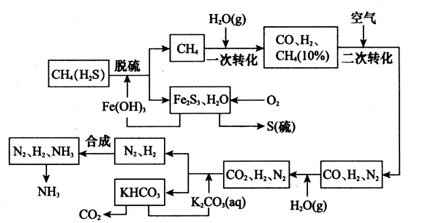
科目: 来源:湖北省模拟题 题型:填空题
 2NH3(g),△H = -92.44kJ/mol;其部分工艺流程如下
2NH3(g),△H = -92.44kJ/mol;其部分工艺流程如下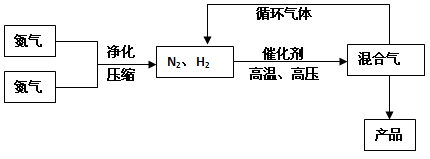

查看答案和解析>>
科目: 来源:辽宁省模拟题 题型:填空题
查看答案和解析>>
科目: 来源:模拟题 题型:填空题
查看答案和解析>>
科目: 来源:模拟题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com