
科目: 来源:2016届山东省高三12月月考化学试卷(解析版) 题型:选择题
下表中的事实与推论不符的是( )
序号 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
D | HCl热稳定性比H2S强 | 非金属性:Cl>S |
查看答案和解析>>
科目: 来源:2016届山东省高三12月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
B.标准状况下,1.12L 16O2和1.12L18O2均含有0.1NA个氧原子
C.0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA
D.常温下,1L 0.1 mol·L-1的Na2CO3溶液中含有的离子总数为0.3NA
查看答案和解析>>
科目: 来源:2016届山东省高三12月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.标准状况下,2.24LCl2溶于水,转移6.02×1022个电子
B.Na2S在空气中长期放置变浑浊的离子方程式为:2S2-+O2+4H+=2S+2H2O
C.NH4HCO3溶液中滴加少量NaOH溶液的离子方程式:HCO3-+OH-=CO32-+H2O
D.在PH=1的溶液中:K+、Fe2+、Cl-、NO3-能够大量共存
查看答案和解析>>
科目: 来源:2016届山东省高三12月月考化学试卷(解析版) 题型:实验题
亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强,食品添加亚硝酸钠必须严格控制用量。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液PH
用PH试纸分别测定0.1mol·L-1两种盐溶液的PH,测得NaNO2溶液呈碱性。NaNO2溶液呈碱性的原因是 ________________________(用离子方程式解释)。NaNO2溶液中c(HNO2)= (用溶液中其它离子的浓度关系式表示)
(2)沉淀法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液。两只试管均产生白色沉淀。分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。
该温度下Ksp(AgNO2)=2×10-8 (mol·L-1)2; Ksp(AgCl)=1.8×10-10(mol·L-1)2
则反应AgNO2(s) +Cl-(aq) AgCl(s)+ NO2-(aq)的化学平衡常数K=
AgCl(s)+ NO2-(aq)的化学平衡常数K=
(3)氧化法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴酸性KMnO4溶液。使酸性KMnO4溶液褪色的是NaNO2溶液。该反应的离子方程式为 。
㈡NaNO2性质探究
该兴趣小组同学用下图装置探究亚硝酸钠与硫酸反应及气体产物成分。

已知: 气体液化的温度:NO2 21℃ 、 NO –152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→ → ______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①如何确认A中产生气体是否含有NO _________。(写出实验操作、现象和结论)
②装置E的作用是_______________________。
③若向D中通入过量O2,则装置B中发生反应的化学方程式为____________。
查看答案和解析>>
科目: 来源:2015-2016学年安徽省高二上学期期中测试化学试卷(解析版) 题型:选择题
某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)  Z(g)+W(s) ΔH>0。下列叙述中,正确的是:
Z(g)+W(s) ΔH>0。下列叙述中,正确的是:
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大
查看答案和解析>>
科目: 来源:2015-2016学年安徽省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列事实中,不能用勒夏特列原理加以解释的是
A.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深
B.合成氨反应N2 + 3H2 2NH3 △H< 0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 △H< 0,为使氨的产率提高,理论上应采取低温高压的措施
C.向醋酸溶液中加入少量的氢氧化钠固体,CH3COO-离子浓度增加
D.盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,气体颜色变浅
查看答案和解析>>
科目: 来源:2015-2016学年安徽省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物分别具有的总能量决定了化学反应是放热反应还是吸热反应
D.当△H<0时表明该反应是吸热反应
查看答案和解析>>
科目: 来源:2015-2016学年安徽省高二上学期期中测试化学试卷(解析版) 题型:选择题
如图表示容积固定的2L密闭容器中进行的某一可逆反应:A(g)+2B(g 2C(g),以B的浓度改变表示的反应速度v正、v逆与时间的关系如图。已知v的单位为mol/(L·s),则图中阴影部分的面积可表示为
2C(g),以B的浓度改变表示的反应速度v正、v逆与时间的关系如图。已知v的单位为mol/(L·s),则图中阴影部分的面积可表示为
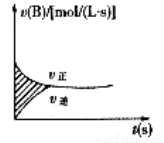
A.A物质的量浓度的减少值 B.B物质的量浓度的减少值
C.C物质的量增加值 D.B物质的量减少值
查看答案和解析>>
科目: 来源:2015-2016学年安徽省高二上学期期中测试化学试卷(解析版) 题型:填空题
在100℃时,将0.200 mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
时间 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050[来 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)该反应的化学方程式为_______________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L?1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol?L?1?s?1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L?1。
查看答案和解析>>
科目: 来源:2015-2016学年安徽省高二上学期期中测试化学试卷(解析版) 题型:填空题
在2L密闭容器内,800℃时反应2NO(g)+O2(g)
 2NO2(g)△H=a KJ·mol-1体系中,n(NO)随时间变化如下表:
2NO2(g)△H=a KJ·mol-1体系中,n(NO)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= 。已知:K(300℃)>K(350 ℃),
 则a 0(填>,<或=)。
则a 0(填>,<或=)。
(2)用NO表示从0~2 s内该反应的平均速率v(NO)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com