
科目: 来源:2016届河南省顶级名校高三上学期期中测试化学试卷(解析版) 题型:选择题
下列关于碱金属某些性质的排列中,正确的是
A.原子半径:Li<Na<K<Rb<Cs
B.密度:Li<Na<K<Rb<Cs
C.熔点、沸点:Li<Na<K<Rb<Cs
D.还原性:Li>Na>K>Rb>Cs
查看答案和解析>>
科目: 来源:2016届河南省顶级名校高三上学期期中测试化学试卷(解析版) 题型:选择题
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是

A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
查看答案和解析>>
科目: 来源:2016届河南省顶级名校高三上学期期中测试化学试卷(解析版) 题型:填空题
乙苯催化脱氢制苯乙烯反应: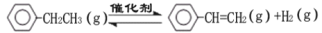
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=__________。
(2)维持体系总压强p恒定,在温度T时,物质的量为n的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的压强平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
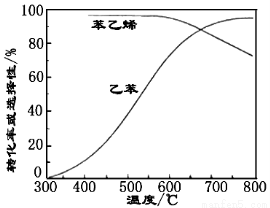
① 掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。
② 控制反应温度为600℃的理由是____________。
(4)某研究机构用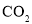 代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;已知该工艺中还能够发生反应:
代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;已知该工艺中还能够发生反应: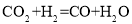 ,
, ,据此可推知新工艺的特点有_________(填编号)。
,据此可推知新工艺的特点有_________(填编号)。
① 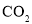 与
与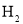 反应,使乙苯脱氢反应的化学平衡右移
反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利用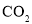 资源利用
资源利用
查看答案和解析>>
科目: 来源:2016届广东省佛山市顺德六校高三上学期期中理综化学试卷(解析版) 题型:选择题
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |

下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
查看答案和解析>>
科目: 来源:2016届广东省佛山市顺德六校高三上学期期中理综化学试卷(解析版) 题型:实验题
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:①Na2S2O3在酸性溶液中不能稳定存在;
②硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2 → S4O62- + 2I- 。
(Ⅰ)制备Na2S2O3·5H2O

①打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热。圆底烧瓶中发生反应的化学方程式 。
②C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。C中碳酸钠的作用是 。D中可能发生的离子反应方程式为: 。“停止C中的反应”的操作是 。
③过滤C中的混合液。将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
④装置B中盛放的试剂是(填化学式) 溶液,其作用是 。
(Ⅱ)用I2的标准溶液测定产品的纯度
取5.5g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是 。
Na2S2O3·5H2O在产品中的质量分数是 (用百分数表示,且保留1位小数)。
查看答案和解析>>
科目: 来源:2015-2016学年浙江省台州市高二上学期第一次月考化学试卷(解析版) 题型:选择题
已知H—H键键能(断裂时吸收或生成时释放的能量)为436 kJ/mol,H—Cl键键能为463kJ/mol,根据热化学方程式:Cl2(g)+H2(g)=2HCl(g) ΔH=-183kJ/mol。则Cl—Cl键的键能是
A.431 kJ/mol
B.307 kJ/mol
C.730 kJ/mol
D.370 kJ/mol
查看答案和解析>>
科目: 来源:2015-2016学年浙江省台州市高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列关于原电池的叙述中,正确的是
A.原电池中,正极就是阳极,负极就是阴极
B.形成原电池时,在负极上发生氧化反应
C.原电池工作时,溶液中的阳离子向负极移动
D.电流从负极流向正极
查看答案和解析>>
科目: 来源:2015-2016学年浙江省台州市高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列关于金属的保护的说法中正确的是
A.以铝为阴极极,可以在铝表面生成一层致密的氧化膜
B.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C.生铁(铁碳合金)比纯铁耐酸能力更强
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
查看答案和解析>>
科目: 来源:2015-2016学年浙江省台州市高二上学期第一次月考化学试卷(解析版) 题型:选择题
在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+3Y(g) 4Z(g),此反应达到平衡的标志是
4Z(g),此反应达到平衡的标志是
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1∶3∶4
D.单位时间消耗0.1 mol X同时生成0.4mol Z
查看答案和解析>>
科目: 来源:2015-2016学年浙江省台州市高二上学期第一次月考化学试卷(解析版) 题型:选择题
反应aA(g)+bB(g) cC(g) 有如下性质: v正=k〔c(A)〕a·〔c(B)〕b,v逆=k·〔c(C)〕c,k在温度一定时为常数,在其他条件不变时,当压强增大一倍则v正应为原来的
cC(g) 有如下性质: v正=k〔c(A)〕a·〔c(B)〕b,v逆=k·〔c(C)〕c,k在温度一定时为常数,在其他条件不变时,当压强增大一倍则v正应为原来的
A.a倍 B.b倍 C.2a倍 D.2a+b倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com