
科目: 来源:2016届陕西省西安市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向醋酸钠水溶液中通入少量CO2
2CH3COO— + CO2+H2O=2CH3COOH + CO32—
B.向FeBr2溶液中通过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
C.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2 + 2Fe3+=2Fe(OH)3 + 3Mg2+
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
科目: 来源:2016届陕西省西安市高三上学期期中测试化学试卷(解析版) 题型:选择题
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶9 C.1∶5 D.2∶9
查看答案和解析>>
科目: 来源:2016届陕西省西安市高三上学期期中测试化学试卷(解析版) 题型:选择题
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O 的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目: 来源:2016届陕西省西安市高三上学期期中测试化学试卷(解析版) 题型:实验题
(12分)某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,同学们阅读资料并设计了如下过程:
Ⅰ.有关资料:铜的化合物颜色性质如下
物质 | 颜色、性质 | 物质 | 颜色、性质 |
氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 |
氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
Ⅱ.探究实验:
(1)提出假设:
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为_______________________。
(2)实验验证:
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物,

①实验前,检查装置A气密性的方法是____________________________。
②实验时,各装置从左至右的连接顺序为A→________→________→B→________→________。
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象①碳棒上的红色物质是否有Cu2O__________(填“是”或“否”),理由是_________________________;
②装置__________(填上图中装置编号)中__________的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式 。
查看答案和解析>>
科目: 来源:2016届陕西省西安市高三上学期期中测试化学试卷(解析版) 题型:填空题
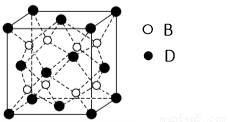
(12分)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式 ;F离子电子排布式 。
(2)写出X的化学式 和化学名称 。
(3)写出X涉及化工生产中的一个化学方程式 。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因: 。
(5)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是: 。
(6)F与B可形成离子化合物,其晶胞结构如图所示: F与B形成离子化合物的化学式为____________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是(只要求列出算式)。
查看答案和解析>>
科目: 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分子式为C2H4O的有机化合物性质相同
B.同温同压下,同体积的任何气体均含有相同的原子数
C.密闭容器中1molN2与3molH2充分反应,产物的分子数为 2×6.02×1023
D.依据右图能量曲线可确定反应:

CH2=CH2(g)+HBr(g)→CH3CH2Br(l)的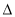 H= (E1+E3-E2-E4)kJ·mol-1
H= (E1+E3-E2-E4)kJ·mol-1
查看答案和解析>>
科目: 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列有关氯气及其含氯分散系的说法正确的是
A.钢铁在Cl2气氛中主要发生电化腐蚀
B.在新制氯水中加入少量CaCO3,溶液中c(HClO)增大
C.反应3Cl2(g) + 8NH3(g) = 6NH4Cl(s) + N2(g)的△H>0,△S<0
D.0.1mol·L-1NaClO溶液中:c(HClO) + c(H+) = c(OH )
)
查看答案和解析>>
科目: 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:选择题
一定温度下,在三个体积均为2.5L的恒容密闭容器中发生反应:
CO2(g)+H2S(g) 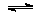 COS(g)+H2O(g)
COS(g)+H2O(g)
容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
Ⅰ | 607 | 0.11 | 0.41 | 0.01 | / |
Ⅱ | 607 | 0.22 | 0.82 | / | |
Ⅲ | 620 | 0.1 | 0.4 | / | 6.74×10-3 |
下列说法正确的是
A.该反应正反应为放热反应
B.607K时该反应的平衡常数为2.50×10-3
C.容器Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D.容器Ⅲ达平衡时,再充入少量氦气,平衡将向正反应方向移动
查看答案和解析>>
科目: 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:实验题
焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH + SO2 = Na2SO3 + H2O ……(a);
Na2SO3+ H2O + SO2 = 2NaHSO3 ……(b);
2NaHSO3 Na2S2O5 + H2O ……(c);
Na2S2O5 + H2O ……(c);
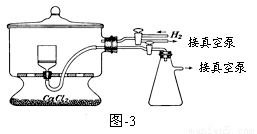
实验装置如下:

(1)实验室可用废铝丝与NaOH溶液反应制取H2,制取H2的离子方程式为 。
(2)图-1装置中,导管X的作用是 。
(3)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为 ;实验后期须保持温度在约80℃,可采用的加热方式为 。
(4)反应后的体系中有少量白色亚硫酸钠析出,参照图-2溶解度曲线,除去其中亚硫酸钠固体的方法是 ;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 。
(5)用图-3装置干燥Na2S2O5晶体时,通入H2的目的是 ;真空干燥的优点是 。
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2 = S4O62-+2I-
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准Na2S2O3溶液滴定至接近终点。
④ 。
⑤ 。
⑥重复步骤①~⑤;根据相关记录数据计算出平均值。
查看答案和解析>>
科目: 来源:2016届江苏省淮安市高三上学期11月月考化学试卷(解析版) 题型:选择题
下列说法错误的是
A.使用可降解塑料聚二氧化碳,能减少白色污染
B.雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮
C.实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境
D.通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com