
科目: 来源:广东省模拟题 题型:填空题
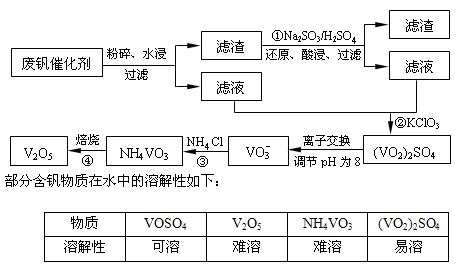
 VO2++H2O+V3+,电池放电时正极的电极反应式为___________。
VO2++H2O+V3+,电池放电时正极的电极反应式为___________。 查看答案和解析>>
科目: 来源:四川省模拟题 题型:填空题

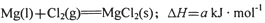
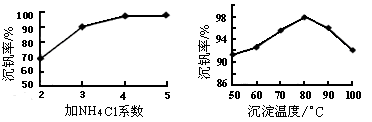
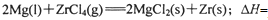 ______________ 该反应在Ar气氛中进行的理由是______________。
______________ 该反应在Ar气氛中进行的理由是______________。 查看答案和解析>>
科目: 来源:山西省模拟题 题型:填空题
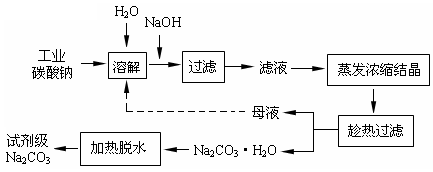
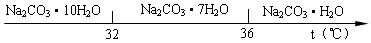
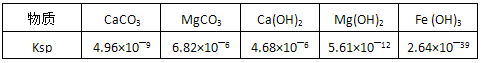
查看答案和解析>>
科目: 来源:广东省模拟题 题型:填空题
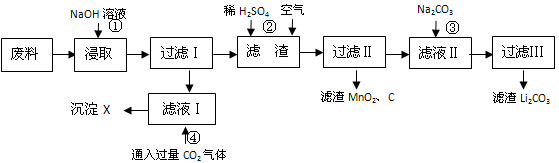
查看答案和解析>>
科目: 来源:广东省模拟题 题型:填空题
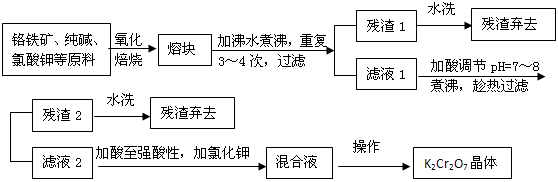

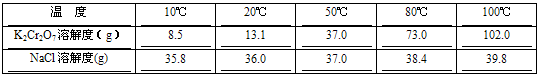
查看答案和解析>>
科目: 来源:江苏期中题 题型:填空题
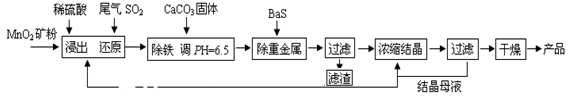
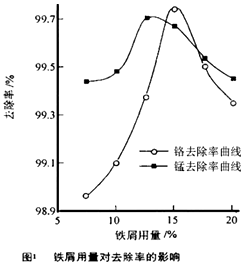

查看答案和解析>>
科目: 来源:江西省模拟题 题型:填空题
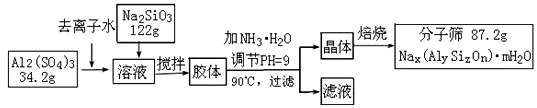
 称为 4A型分子筛;当Na+被Ca2+取代时就制得 5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65
称为 4A型分子筛;当Na+被Ca2+取代时就制得 5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65 )和异丁烷(分子直径为5.6
)和异丁烷(分子直径为5.6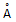 )应该选用_________型的分子筛。
)应该选用_________型的分子筛。 查看答案和解析>>
科目: 来源:广东省模拟题 题型:填空题
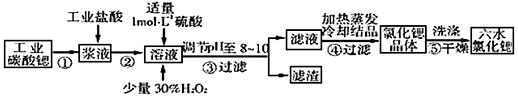

查看答案和解析>>
科目: 来源:湖北省模拟题 题型:填空题


查看答案和解析>>
科目: 来源:吉林省模拟题 题型:填空题

 Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。
Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。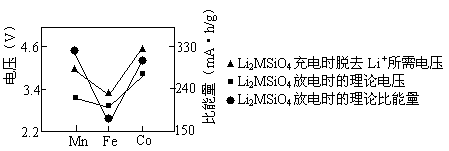
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com