
科目: 来源:山东省模拟题 题型:填空题
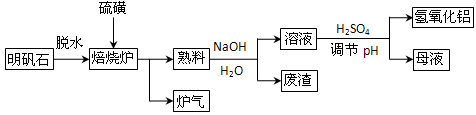
 2Al2O3 +9SO2,该反应的氧化剂是____________,若生成1mol Al2O3,则转移的电子数为____________ 。
2Al2O3 +9SO2,该反应的氧化剂是____________,若生成1mol Al2O3,则转移的电子数为____________ 。查看答案和解析>>
科目: 来源:江西省模拟题 题型:填空题
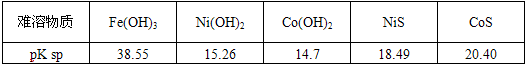
查看答案和解析>>
科目: 来源:陕西省模拟题 题型:填空题
(三选一----化学与技术)
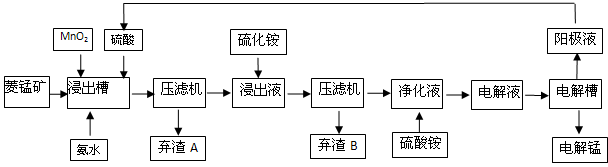
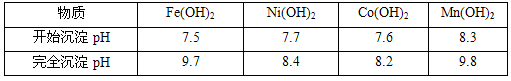
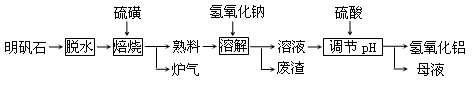
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
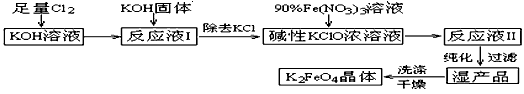
查看答案和解析>>
科目: 来源:江西省月考题 题型:填空题
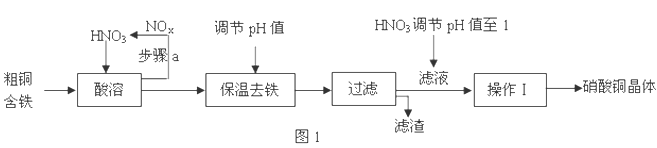


查看答案和解析>>
科目: 来源:福建省月考题 题型:填空题


查看答案和解析>>
科目: 来源:吉林省期中题 题型:填空题

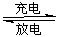 Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。
Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。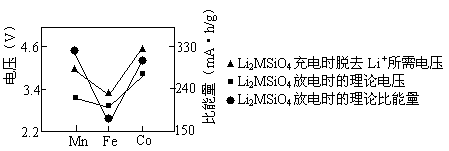
查看答案和解析>>
科目: 来源:河南省模拟题 题型:填空题
 2Al2O3 +_________;该反应的氧化剂是________;该反应中被氧化的元素与被还原的元素的质量比是________ 。
2Al2O3 +_________;该反应的氧化剂是________;该反应中被氧化的元素与被还原的元素的质量比是________ 。查看答案和解析>>
科目: 来源:江苏专项题 题型:填空题

 2Al2O3 +9SO2 ,其中氧化剂为__________。
2Al2O3 +9SO2 ,其中氧化剂为__________。 查看答案和解析>>
科目: 来源:江苏模拟题 题型:填空题
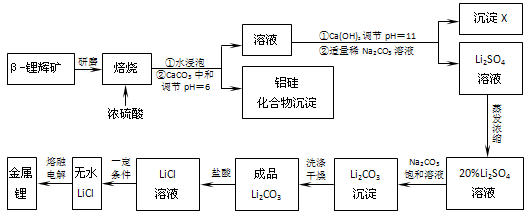
查看答案和解析>>
科目: 来源:江苏模拟题 题型:填空题

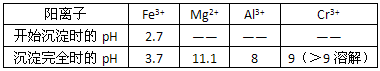
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com