
科目: 来源:专项题 题型:填空题
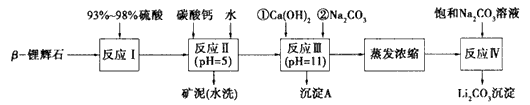
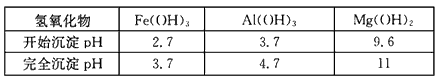
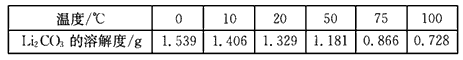
查看答案和解析>>
科目: 来源:专项题 题型:单选题
查看答案和解析>>
科目: 来源:江苏月考题 题型:填空题

查看答案和解析>>
科目: 来源:同步题 题型:填空题

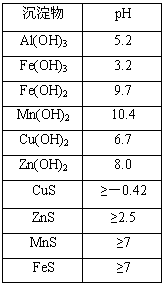
查看答案和解析>>
科目: 来源:云南省同步题 题型:单选题
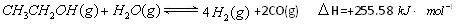
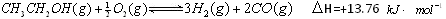
查看答案和解析>>
科目: 来源:云南省同步题 题型:填空题

查看答案和解析>>
科目: 来源:云南省同步题 题型:填空题
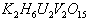 ,钒元素为+5价,相对原子质量为51)。请回答下列问题:
,钒元素为+5价,相对原子质量为51)。请回答下列问题: 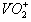 再用草酸测定钒。总反应式可表示为:
再用草酸测定钒。总反应式可表示为: 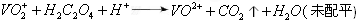
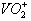 的化学计量数为_____________。
的化学计量数为_____________。 查看答案和解析>>
科目: 来源:同步题 题型:填空题

查看答案和解析>>
科目: 来源:0110 模拟题 题型:填空题




查看答案和解析>>
科目: 来源:江苏高考真题 题型:填空题
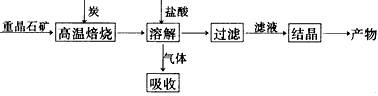
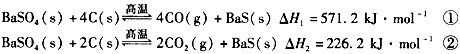
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为______________________
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时 __________________
__________________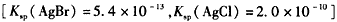
(3)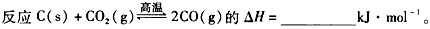
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是______________、______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com