
科目: 来源:2016届黑龙江双鸭山第一中学高三上学期期中测试化学试卷(解析版) 题型:填空题
(14分)元素周期表的用途广泛。
(1)用“>”或“<”填空:
离子半径 | 非金属性 | 酸性 | 沸点 |
K+_____S2- | N____O | 硫酸_____高氯酸 | HF____HCl |
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液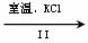 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。

①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)
查看答案和解析>>
科目: 来源:2016届湖北省、宜昌一中高三上10月联考化学试卷(解析版) 题型:选择题
下列实验操作或处理事故的方法正确的是
A.用干燥的pH试纸测定NaClO溶液的pH
B.在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验
C.用分液漏斗分离溴苯和水的混合物时,溴苯从下口放出,水从上口倒出
D.欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中
查看答案和解析>>
科目: 来源:2016届湖北省、宜昌一中高三上10月联考化学试卷(解析版) 题型:选择题
下列离子组在指定的溶液中能大量共存的是
A.与铝粉反应放出H2的无色溶液:NO3-、Al3+、Na+、SO42-
B.使红色石蕊试纸变蓝的溶液:SO42-、HCO3-、Na+、K+
C.中性溶液:Fe3+、Al3+、NO3-、SO42-
D.常温下c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
查看答案和解析>>
科目: 来源:2016届湖北省、宜昌一中高三上10月联考化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3 = 2Cu2++CO2↑+3H2O
B.将Na2O2固体投入H218O中:2H218O+2Na2O2 = 4OH-+4Na++18O2↑
C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:
2Ba2++NH4++Al3++2SO42-+4OH- = Al(OH)3↓+NH3·H2O+2BaSO4↓
D.向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20 H+ = 4Fe3++3O2↑+10H2O
查看答案和解析>>
科目: 来源:2016届湖北省、宜昌一中高三上10月联考化学试卷(解析版) 题型:选择题
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,向溶液中通入氯气,使溶液中Cl-和Br-的个数比为7:3(已知还原性I->Fe2+>Br->Cl-),则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为
A.5:4 B.4:5 C.5:12 D.12:5
查看答案和解析>>
科目: 来源:2016届湖北省、宜昌一中高三上10月联考化学试卷(解析版) 题型:实验题
(9分)硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图所示
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下:
步骤1:如图连接好装置后, ,将D中导管末端浸入水中,微热烧瓶观察气泡和水柱检查装置A、C、D气密性。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。装置B中的药品可选用下列物质中的。
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHSO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少,当C中溶液的pH 接近7时,打开K2 ,关闭K1即停止C中的反应,停止加热。“当C中溶液的pH接近7时即停止C中的反应”的原因是______________________(用离子方程式表示)。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式_________________。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL ,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后得混合溶液V mL,将其分成4等份,加入淀粉溶液作指示剂,用0.0010 mol·L-1 的Na2S2O3溶液进行滴定,相关数据记录如下表所示:
编号 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
部分反应离子方程式为:
①Cr2O72- + 6I- + 14H+ = 2Cr3+ + 3I2 + 7H2O ;②I2 + 2S2O32- = 2I- + S4O64-。
则判断达到滴定终点的现象是__________________。
废水中Ba2+的物质的量浓度为__________________。
查看答案和解析>>
科目: 来源:2016届湖北省高三上期中理综化学试卷(解析版) 题型:选择题
2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素。已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是

A.分子式为C15H22O5
B.能够发生水解反应
C.每个分子中含有4个六元环
D.青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关
查看答案和解析>>
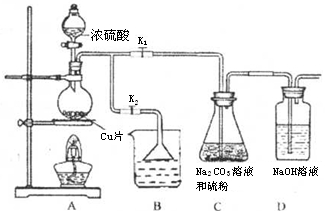
科目: 来源:2016届湖北省高三上期中理综化学试卷(解析版) 题型:选择题
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是
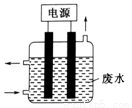
A.可以用石墨作阳极,作铁阴极
B.除去CN-的反应:2CN-+5ClO-+ 2H+ =N2↑+2CO2↑+5Cl-+H2O
C.阴极的电极反应式为:Cl-+2OH- +2e-= ClO-+H2O
D.阳极的电极反应式为:2CN-+12OH- -10e-=N2↑+2CO32-+6H2O
查看答案和解析>>
科目: 来源:2016届湖北省高三上期中理综化学试卷(解析版) 题型:填空题
(14分)某晶体(结晶水合物)由五种短周期元素组成。常温下,将该晶体溶于蒸馏水后可电离出三种离子(忽略水的电离),其中两种离子含有的电子数均为10个。将该溶液分成等量2份,一份中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀;向另一份中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。
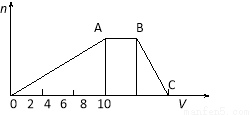
请回答下列问题:
(1)若该晶体的摩尔质量为906g·mol-1,写出该晶体的化学式 ;
(2)B点溶液的pH 7(填“<”、“>”或“=”),用化学用语表示其原因 。
(3)若向该晶体的水溶液中逐滴加入Ba(OH)2溶液至产生最多的沉淀,写出该变化的离子方程式 。
(4)C点溶液中所含溶质的化学式为 ;此时溶液中各种离子浓度由大到小顺序为 。
查看答案和解析>>
科目: 来源:2016届湖北省高三上期中理综化学试卷(解析版) 题型:填空题
【化学选修3:物质结构与性质】(15分)
(1)美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型。多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是 。
A、NO2-和NH4+ B、H3O+和ClO3- C、NO3-和CO32- D、PO43-和SO42-
(2)铜、锌两种元素的第一电离能、第二电离能如表所示
电离能/kJ·mol-1 | I1 | I2 |
铜 | 746 | 1958 |
锌 | 906 | 1733 |
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 。
(3)石墨烯是从石墨材料中剥离出来、由碳原子组成的只有一层原子厚度的二维晶体。其结构如图:

有关说法正确的是
A、固态时,碳的各种单质的晶体类型相同 B、石墨烯中含有非极性共价键
C、从石墨中剥离石墨烯需要破坏化学键 D、石墨烯具有导电性
(4)最近科学家成功以CO2为原料制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以4个共价单键与氧原子结合为一种空间网状的无限延伸结构,则该晶体中碳原子采用 杂化与周围氧原子成键;晶体中碳氧原子个数比为 ;碳原子数与C-O化学键数之比为 。
(5)已知钼(Mo)的晶胞为体心立方晶胞,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏伽德罗常数的值,请写出金属钼密度的计算表达式 g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com