
科目: 来源:2015-2016学年山西太原五中高二上第一周考理科化学试卷(解析版) 题型:选择题
下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)═C(石墨)△H=-1.9kJ/mol 可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ
D.在25 ℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1
查看答案和解析>>
科目: 来源:2015-2016学年山西太原五中高二上第一周考理科化学试卷(解析版) 题型:选择题
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目: 来源:2015-2016学年山西太原五中高二上第一周考理科化学试卷(解析版) 题型:选择题
已知:2Zn(s) + O2(g)= 2ZnO(s) △H1= -701.0kJ·mol-1,2Hg(l)+ O2(g)= 2HgO(s) △H2= -181.6kJ·mol-1,则反应Zn(s) + HgO(s)= ZnO(s) + Hg(l)的△H为:
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
查看答案和解析>>
科目: 来源:2015-2016学年山西太原五中高二上第一周考理科化学试卷(解析版) 题型:选择题
反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率V(x)可表示为
A.V(NH3)=0.010mol/(L·S) B.V(O2)=0.0010mol/(L·S)
C.V(NO)=0.0010mol/(L·S) D.V(H2O)=0.045mol/(L·S)
查看答案和解析>>
科目: 来源:2015-2016学年山西太原五中高二上第一周考理科化学试卷(解析版) 题型:选择题
在合成氨反应中:N2+3H2 2NH3经过一段时间,NH3的浓度增加了0.6mol/L,在此段时间内用V(H2)表示反应速率为V(H2)=0.45mol/(L·S),则这段时间为
2NH3经过一段时间,NH3的浓度增加了0.6mol/L,在此段时间内用V(H2)表示反应速率为V(H2)=0.45mol/(L·S),则这段时间为
A、0.44S B、1S C、1.33S D、2S
查看答案和解析>>
科目: 来源:2015-2016学年山西太原五中高二上第一周考理科化学试卷(解析版) 题型:选择题
把0.6molX气体和 0.4molY气体混和于2 L密闭容器中发生反应:
3X(g)+Y(g) nZ(g)+2W(g)5 min末生成0.2molW,若测知以Z浓度变化表示的反应平均速率为0.01mol·L-1·min-1,则上述反应中化学计量数n值是
nZ(g)+2W(g)5 min末生成0.2molW,若测知以Z浓度变化表示的反应平均速率为0.01mol·L-1·min-1,则上述反应中化学计量数n值是
A、1 B、2 C、3 D、4
查看答案和解析>>
科目: 来源:2015-2016学年山西太原五中高二上第一周考理科化学试卷(解析版) 题型:选择题
化学反应N2+3H2 2NH3的能量变化下图所示,该反应的热化学方程式是
2NH3的能量变化下图所示,该反应的热化学方程式是
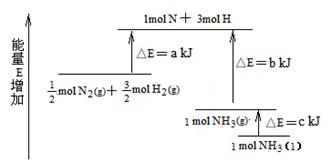
A.N2(g)+3H2(g)  2NH3(1);△H=2(a-b-c)kJ·mol-1
2NH3(1);△H=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)  2NH3(g);△H=-2(b+a)kJ·mol-1
2NH3(g);△H=-2(b+a)kJ·mol-1
C. N2(g)+
N2(g)+ H2(g)
H2(g) 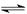 NH3(1);△H=(b+c-a)kJ·mol-1
NH3(1);△H=(b+c-a)kJ·mol-1
D. N2(g)+
N2(g)+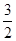 H2(g)
H2(g) 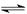 NH3(g);△H=(a+b)kJ·mol-1
NH3(g);△H=(a+b)kJ·mol-1
查看答案和解析>>
科目: 来源:2015-2016学年山西太原五中高二上第一周考理科化学试卷(解析版) 题型:填空题
(1)家用液化气的主要成分之一是丁烷(C4H10),当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式 。
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ/mol、-283.0 kJ/mol和-726.5 kJ/mol。请回答下列问题:
①用太阳能分解10 mol水消耗的能量是 kJ;
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 ;
③研究NO2、SO2、CO等大气污染气体的处理具有重要意义,已知:
2SO2(g)+O2(g) = 2SO3(g) ΔH=-196.6 kJ/mol
2NO(g)+O2(g) = 2NO2(g) ΔH=-113.0 kJ/mol
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的ΔH= kJ/mol。
(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ•mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ•mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
写出CO(g)还原FeO(s)得到Fe(s)体和CO2(g)的热化学反应方程式 .
查看答案和解析>>
科目: 来源:2015-2016学年贵州省高二上第一半月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化一定伴随着能量变化[
查看答案和解析>>
科目: 来源:2015-2016学年贵州省高二上第一半月考化学试卷(解析版) 题型:选择题
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、890.3 kJ·mol-1、2 800 kJ·mol-1,则下列热化学方程式正确的是
A.C(s)+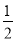 O2(g)===CO(g) ΔH=-393.5 kJ·mol-1
O2(g)===CO(g) ΔH=-393.5 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=+571.6 kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D.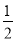 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com