
科目: 来源:2015-2016学年山东寿光中学高二上10月月考化学试卷(解析版) 题型:选择题
某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则下列说法正确的是

A、电流方向:电极IV→ →电极I
→电极I
B、电极I发生还原反应
C、电极II逐渐溶解
D、电极III的电极反应:Cu2++2e-==Cu
查看答案和解析>>
科目: 来源:2015-2016学年山东寿光中学高二上10月月考化学试卷(解析版) 题型:选择题
下列与金属腐蚀有关的说法正确的是

A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目: 来源:2015-2016学年山东寿光中学高二上10月月考化学试卷(解析版) 题型:填空题
(12分)I、 肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧的热化学方程式是_________________________
II、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和液态水,放出327.05kJ的热量。
(1)写出该反应的热化学方程式_______________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和水蒸气时,放出的热量是______________kJ。
(3)已知N2(g)+2O2(g)====2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式__________________。
III、肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:_________________________;
负极的电极反应式:_______________________ __。
查看答案和解析>>
科目: 来源:2015-2016学年辽宁师大附属中学高二10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.反应热就是反应中放出的能量
B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
C.由C(s,石墨)= C(s,金刚石),ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
查看答案和解析>>
科目: 来源:2015-2016学年辽宁师大附属中学高二10月月考化学试卷(解析版) 题型:选择题
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目: 来源:2015-2016学年辽宁师大附属中学高二10月月考化学试卷(解析版) 题型:选择题
在固定容积的密闭容器中,可逆反应2X(?)+Y(g) Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是
Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是
A.正反应为放热反应,X可能是气态、液态或固态
B.正反应为放热反应,X一定为气态
C.若X为非气态,则正反应为吸热反应
D.若加入少量的Z,该平衡向左移动
查看答案和解析>>
科目: 来源:2015-2016学年辽宁师大附属中学高二10月月考化学试卷(解析版) 题型:选择题
可逆反应N2(g)+3H2(g) 2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知Q1=4Q2。下列叙述不正确的是
2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知Q1=4Q2。下列叙述不正确的是
A.达到平衡时,两容器中反应物的转化率不同
B.达到平衡时,甲中NH3的体积分数与乙相等
C.达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动
D.乙中的热化学反应方程式为2NH3(g) N2(g)+3H2(g);△H=+Q2KJ/mol
N2(g)+3H2(g);△H=+Q2KJ/mol
查看答案和解析>>
科目: 来源:2015-2016学年辽宁师大附属中学高二10月月考化学试卷(解析版) 题型:填空题
(14分)(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;
FeO(s)+CO(g) △H1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+ H2(g) CO(g)+ H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g)
CO(g)+ H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g) CO(g)+ H2O(g)是 反应(填“吸热”或“放热”)。
CO(g)+ H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g)+ H2(g) CO(g)+ H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g)+ H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O
D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
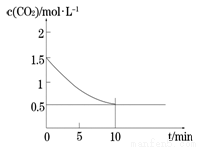
①该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时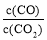 增大的是____________(填序号)。
增大的是____________(填序号)。
A.升高温度
B.增大压强
C.充入一定量的CO2
D.再加入一定量铁粉
查看答案和解析>>
科目: 来源:2015-2016学年辽宁师大附属中学高二10月月考化学试卷(解析版) 题型:填空题
(8分)过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途。
(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l)+O2(g)===N2(g)+2H2O(g),ΔH=-534 kJ·mol-1
H2O2(l)===H2O(l)+ O2(g),ΔH=-98 kJ·mol-1
O2(g),ΔH=-98 kJ·mol-1
H2O(l)===H2O(g),ΔH=+44 kJ·mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式_________________________。
(2)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g) NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示。由图可得出的正确说法是________________。
NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示。由图可得出的正确说法是________________。
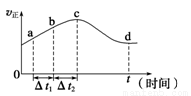
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
查看答案和解析>>
科目: 来源:2015-2016学年吉林省高一上期中测试化学试卷(解析版) 题型:选择题
容量瓶上需标有:①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式;六项中的
A.①③⑤ B.③⑤⑥ C.①②④ D.②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com