
科目: 来源:新疆自治区月考题 题型:单选题
查看答案和解析>>
科目: 来源:河南省模拟题 题型:单选题
| 硫代硫酸钠溶液与盐酸的反应(Na2S2O3+2HCl===2NaCl+S+SO2+H2O ),可用于探究浓度对于反应速率的影响。常温常压下,若该反应产生固体单质16 g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数) | ||||||||||||||||||||
|
[ ] | ||||||||||||||||||||
|
查看答案和解析>>
科目: 来源:陕西省期中题 题型:单选题
查看答案和解析>>
科目: 来源:陕西省期中题 题型:单选题
查看答案和解析>>
科目: 来源:福建省期中题 题型:单选题
查看答案和解析>>
科目: 来源:福建省期中题 题型:填空题
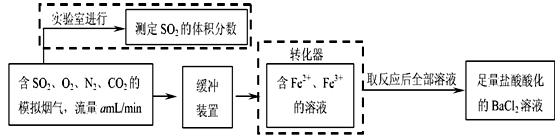

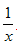 Sx 、 CO+
Sx 、 CO+ 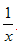 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+ 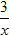 Sx 。其中COS中“C”化合价为____________。
Sx 。其中COS中“C”化合价为____________。查看答案和解析>>
科目: 来源:广西自治区月考题 题型:填空题
查看答案和解析>>
科目: 来源:山东省期中题 题型:填空题
查看答案和解析>>
科目: 来源:四川省模拟题 题型:单选题
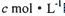 的硝酸溶液中恰好完全反应,生成dmol NO气体,得到
的硝酸溶液中恰好完全反应,生成dmol NO气体,得到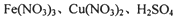 的混合液,则反应中未被还原的硝酸不可能为
的混合液,则反应中未被还原的硝酸不可能为 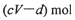
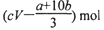
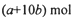
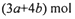
查看答案和解析>>
科目: 来源:同步题 题型:单选题
[ ]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com