
科目: 来源:2016届河北省冀州市高三复习班上第一次月考化学试卷A(解析版) 题型:选择题
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32- 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是

A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中一定含有SO42— 和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
D.反应最后形成的溶液中含有的溶质为Na2SO4
查看答案和解析>>
科目: 来源:2016届河北省冀州市高三复习班上第一次月考化学试卷A(解析版) 题型:实验题
(10分)某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用,实验过程如下:
过程Ⅰ:
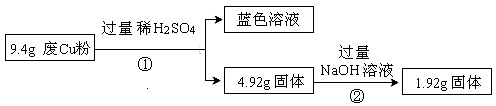
(1)废Cu粉中一定含有的杂质是 (填化学式)。
(2)写出过程②发生反应的离子方程式: 。
过程Ⅱ:
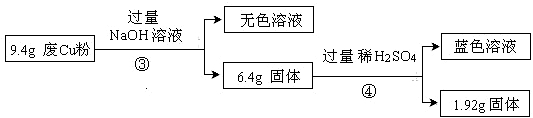
(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是 (化为最简整数比)
过程Ⅲ:已知25℃时:
电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶度积(Ksp) | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
(4)在Ⅱ中所得蓝色溶液中加入一定量的H2O2 溶液,调节溶液的pH范围为 ,然后过滤、结晶,可得CuSO4·5H2O。
(5)下列与 Ⅲ方案 相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+ 氧化为Fe3+ 的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第一阶段考试理综化学试卷(解析版) 题型:选择题
已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为: 3Fe2++2S2O32-+O2+4OH-= Fe3O4+S4 O62-+2H2O。下列说法正确的是
A.O2和S2O32-是氧化剂,Fe2+是还原剂
B.每生成1 mol Fe3O4,转移电子的物质的量为2 mol
C.若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol
D.参加反应的氧化剂与还原剂的物质的量之比为1∶1
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第一阶段考试理综化学试卷(解析版) 题型:实验题
(13分)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡 工业。某研究小组设计SnSO4制备路线如下:
工业。某研究小组设计SnSO4制备路线如下:

查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 。
 (2)操作Ⅰ是 。
(2)操作Ⅰ是 。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两个:①调节溶液pH ② 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为: 6FeCl 2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O
2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是 。
查看答案和解析>>
科目: 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关物质性质或应用的说法正确的是
A.二氧化锰具有强氧化性,能将双氧水氧化为氧气
B.Zn具有氧化性和导电性,可用作锌锰干电池的负极材料
C.炭具有强还原性,高温下能将二氧化硅还原为硅
D.二氧化硫具有漂白性,与氯水混合使用效果会更好
查看答案和解析>>
科目: 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关溶液组成的描述合理的是
A.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
B.酸性溶液中可能大量存在Na+、ClO-、SO42-、I-
C.常温下在c(H+)=1×10-13 mol?L-1的溶液中能大量存在Mg2+、Cu2+、SO42-、NO3-
D.加入铝粉能产生氢气的溶液中大量存在NH4+、Fe2+、SO42-、NO3-
查看答案和解析>>
科目: 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法不正确的是
A.原子半径大小顺序:r(Z)>r(W)>r(X)>r(Y)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的强
D.Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
科目: 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目减少的是
A.Na+ B.Fe3+ C.Al3+ D.Fe2+
查看答案和解析>>
科目: 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:实验题
(18分)1000mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(所加试剂均过量):
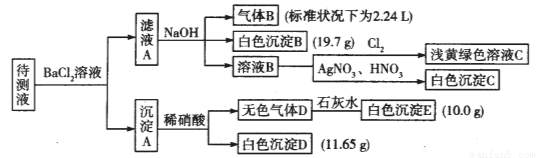
(1)写出生成白色沉淀B的离子方程式:_______________。
(2)待测液中肯定不存在的阳离子是_____________。
(3)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
浓度/ mol·L-1 |
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:__________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是__________。
②沉淀A中能还原稀硝酸的成分是________________(写化学式)。
查看答案和解析>>
科目: 来源:2016届西藏日喀则地区一中高三10月月考理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3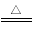 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com