
科目: 来源:2016届福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
水热法制备Fe3O4纳米颗粒的反应为:
3Fe2++2S2O32-+O2+xOH-===Fe3O4+S4O62-+2H2O,下列说法中错误的是
A.每生成1 mol Fe3O4,反应转移的电子总数为4 mol
B.Fe2+和S2O32-都是还原剂
C.1 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为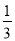 mol
mol
D.x=4
查看答案和解析>>
科目: 来源:2016届福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列实验装置设计正确、且能达到目的的是

A.实验Ⅰ:制取金属钠
B.实验II:制取Fe(OH)2
C.实验Ⅲ:制取少量的氢氧化铝
D.实验Ⅳ:比较两种物质的热稳定性
查看答案和解析>>
科目: 来源:2016届福建省高三上学期12月月考化学试卷(解析版) 题型:填空题
高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:
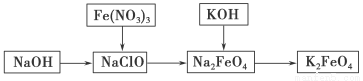
(1)高铁酸钾中铁元素的化合价为________,推测它具有的化学性质是__________________。
(2) 已知Fe2O3与KNO3和KOH的混合物加热共融也可制得高铁酸钾。完成并配平下列化学方程式:

(3)将KOH加入含Na2FeO4的溶液中搅拌半小时,静置,过滤粗产品,该过程发生的反应为2KOH+Na2FeO4===K2FeO4+2NaOH,根据复分解反应原理,高铁酸钠的溶解度________(填“大于”、“小于”或“等于”)高铁酸钾的溶解度。
(4)为测定含铁溶液中铁元素的总含量,实验操作:
①准确量取20.00mL含铁溶液于带塞锥形瓶中,加入足量H2O2,待充分反应后,加热除去过量H2O2;
②加入过量KI充分反应后,再用0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00 ml。已知: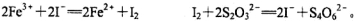
①写出滴定选用的指示剂 ,滴定终点观察到的现象 。
②溶液Ⅰ中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会 (填“偏高” “偏低” “不变”)。
查看答案和解析>>
科目: 来源:2015-2016学年四川省高一上第三次月考化学试卷(解析版) 题型:选择题
下列性质的比较中,不正确的是
A.稳定性:Na2CO3>NaHCO3 B.熔点:生铁>纯铁
C.酸性:H2CO3>HClO D.氧化性:Fe3+>Cu2+
查看答案和解析>>
科目: 来源:2015-2016学年四川省高一上第三次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.500 mL1 mol/L MgCl2溶液中含有Cl-数目为0.5NA
B.标准状况下,33.6L SO3与48gO2所占的体积相等
C.17 gNH3含有的电子个数为l0NA
D.1 mol O2与2 mol SO2一定条件下混合反应,可生成2 mol SO3
查看答案和解析>>
科目: 来源:2015-2016学年四川省高一上第三次月考化学试卷(解析版) 题型:选择题
下列实验操作正确的是
A.蒸发时,将蒸发皿放置在铁架台的铁圈上直接用酒精灯外焰加热
B.蒸馏时,温度计水银球浸入蒸馏烧瓶内液面下,冷凝水从冷凝管下口进
C.萃取时,分别用两个烧杯从下口接收有机层和水层
D.配制100ml 0.100 mol/L的硫酸铜溶液时,可将2.50克胆矾溶于100mL蒸馏水中
查看答案和解析>>
科目: 来源:2015-2016学年四川省高一上第三次月考化学试卷(解析版) 题型:选择题
在含有Fe3+、Fe2+、Al3+、Na+的稀溶液中,加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目减少的是
A.Fe3+ B.Al3+ C.Na+ D.Fe2+
查看答案和解析>>
科目: 来源:2015-2016学年四川省高一上第三次月考化学试卷(解析版) 题型:选择题
下列变化不属于氧化还原反应的是
A.Na2SO3溶液在空气中变质 B工业上炼铁
C.二氧化硫的漂白原理 D.将氯气通入冷的消石灰浊液中
查看答案和解析>>
科目: 来源:2015-2016学年四川省高一上第三次月考化学试卷(解析版) 题型:选择题
把200 mL有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则原混合溶液中钾离子物质的量浓度为
A.0.1(b-2a) mol/L B.10(2a-b) mol/L
C.10(b-a) mol/L D.10(b-2a) mol/L
查看答案和解析>>
科目: 来源:2015-2016学年四川省高一上第三次月考化学试卷(解析版) 题型:填空题
(15分)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
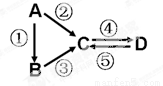
(1)若A是当前最常用的太阳能转换为电能的材料。
(2)C的水溶液俗称水玻璃,D为硅酸。则:写出反应②的化学方程式 。写出反应③的离子方程式 。
(2)若A是应用最广泛的金属。反应①、⑤均用盐酸,D物质是红褐色。则:
写出反应③的化学方程式 。B溶液中加入NaOH溶液的现象是 ,沉淀颜色发生变化对应的化学方程式是 。
C的溶液用于蚀刻印刷铜电路板(铜质),写该反应的离子方程式 。
(3)若D物质是常见的两性氢氧化物,反应②③⑤均要用强碱溶液,反应④是通入过量的CO2。则:反应②的离子方程式为 。反应④的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com