
科目: 来源:2016届河北省高三上学期第四次月考化学试卷(解析版) 题型:填空题
在一定体积的密闭容器中进行某化学反应,其平衡常数表达式为K=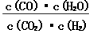 。
。
化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学方程式为 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
℃。
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于__________mol。
查看答案和解析>>
科目: 来源:2016届广东省高三上12月联考理综化学试卷(解析版) 题型:选择题
下列实验对应的现象及结论均正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | SO2通入BaCl2溶液,然后滴入稀硝酸 | 白色沉淀,白色沉淀不溶于稀硝酸 | 所得沉淀为BaSO3,后转化为BaSO4 |
B | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
C | 向FeCl2溶液中加入足量Na2O2粉末 | 出现红褐色沉淀和无色气体 | FeCl2溶液部分变质 |
D | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
查看答案和解析>>
科目: 来源:2016届广东省高三上12月联考理综化学试卷(解析版) 题型:选择题
硫酸锌是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,医药上用于催吐剂。已知25 ℃时,Ksp[Zn(OH)2]=1.0×10-17, Ksp[Ag2SO4]=1.2×10-5,则下列说法正确的是
A.在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动, Kw减小
B.在ZnSO4溶液中各离子的浓度关系为:c(Zn2+)+c(H+)=c(OH-)+c(SO42-)
C.在0.5 L 0.10 mol·L-1的ZnSO4溶液中加入等体积的0.02 mol·L-1的AgNO3溶液,即可生成Ag2SO4沉淀
D.常温下,要除去0.20 mol·L-1 ZnSO4溶液中的Zn2+,至少要调节pH≥8
查看答案和解析>>
科目: 来源:2016届广东省等三校高三上学期12月联考理综化学试卷(解析版) 题型:选择题
某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:则符合上述条件的酯的结构可有

A.2种 B.4种 C.6种 D.8种
查看答案和解析>>
科目: 来源:2016届广东省等三校高三上学期12月联考理综化学试卷(解析版) 题型:选择题
利用右图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl > C > Si | |
B | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
C | 浓氨水 | 碱石灰 | AlCl3溶液 | Al(OH)3是两性氢氧化物 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
查看答案和解析>>
科目: 来源:2016届广东省等三校高三上学期12月联考理综化学试卷(解析版) 题型:填空题
减少污染、保护环境是全世界最热门的课题。
I.CO在催化剂作用下可以与H2反应生成甲醇:
①CO(g)+2H2(g) 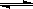 CH3OH(g),△H1
CH3OH(g),△H1
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 876 | 465 | 413 |
由此计算△H1= 。
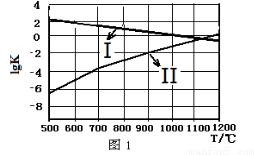
(2)图1中能正确反映反应①平衡常数的对数lgK随反应温度T的变化曲线为 (填曲线标记字母),其判断理由是 。
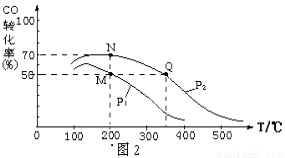
(3)在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图2。
①P1 P2(填“大于”或“小于”),其判断理由是 。
②M、N、Q三点平均速率ν(M)、ν(N)、ν(Q)大小关系为 。
③M、N、Q三点平衡常数KM、KN、KQ大小关系为 。
II.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)  2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示。已知:气体分压(P分)= 气体总压(P总)× 体积分数。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示。已知:气体分压(P分)= 气体总压(P总)× 体积分数。
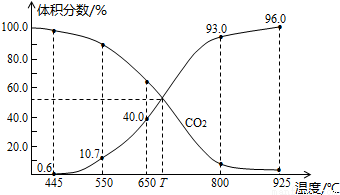
完成下列填空:
①650℃时,反应达平衡后CO2的转化率为 。
②T℃时,若充入等体积的CO2和CO,平衡 (填“向左移动”、“向右移动”或“不移动”)
③925℃时,P总=1/96MPa,用平衡分压代替平衡浓度表示的化学平衡常数KP= 。
查看答案和解析>>
科目: 来源:2016届福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
化学与日常生活密切相关,下列说法错误的是
A.Si可用于制造半导体材料
B.二氧化硫可广泛用于食品的增白
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.84消毒液的有效成分是NaClO,可用于环境的消毒杀菌
查看答案和解析>>
科目: 来源:2016届福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列关于金属腐蚀的叙述不正确的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.与生铁相比纯铁更容易被腐蚀
C.金属的吸氧腐蚀和析氢腐蚀都属于电化学腐蚀
D.金属腐蚀的本质是M - ne‑ = Mn+
查看答案和解析>>
科目: 来源:2016届福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
运用盖斯定律可方便地计算出难以通过实验直接测定的反应热。已知:P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1 ,P(红磷,s)+ O2(g)=
O2(g)= P4O10(s) ΔH=-738.5kJ·mol-1 ,则白磷转化为红磷的热化学方程式为
P4O10(s) ΔH=-738.5kJ·mol-1 ,则白磷转化为红磷的热化学方程式为
A. P4(白磷,s)=4P(红磷,s) △H=-29.2kJ·mol-1
B. P4(白磷,s)=4P(红磷,s) △H=+29.2kJ·mol-1
C. P4(白磷,s)=4P(红磷,s) △H=-2244.7kJ·mol-1
D. P4(白磷,s)=4P(红磷,s) △H=+2244.7kJ·mol-1
查看答案和解析>>
科目: 来源:2016届福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.醋酸溶解鸡蛋壳:2H++ CO32-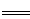 CO2↑+ H2O
CO2↑+ H2O
B.铝片加入烧碱溶液:2A1+ 2OH-+ 2H2O 2A1O2-+ 3H2↑
2A1O2-+ 3H2↑
C.铁与盐酸反应:2Fe + 6H+ 2Fe3+ + 3H2↑
2Fe3+ + 3H2↑
D.铜片投入FeCl3溶液中:Cu+ Fe3+ Cu2+ + Fe2+
Cu2+ + Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com