
科目: 来源:2016届宁夏固原一中高三上适应性训练理综化学试卷(解析版) 题型:选择题
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl2(g) PCl5(g) ΔH<0。有关数据如下:
PCl5(g) ΔH<0。有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度/(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大
C.当容器中Cl2为1.2 mol时,反应达到平衡
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目: 来源:2016届宁夏固原一中高三上适应性训练理综化学试卷(解析版) 题型:推断题
从海水中提取一些重要的化工产品的工艺流程如图所示。
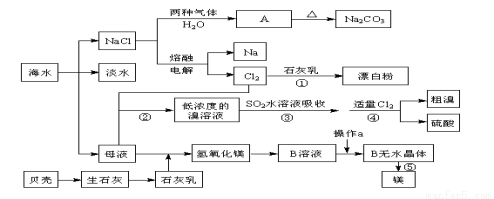
根据上述流程图回答下列问题:
(1)图中A的化学式为____________,在制取A的过程中需向饱和NaCl溶液中先后通入两种气体,后通入气体的化学式为_____________________。
(2)海水淡化处理的方法有______________________________。(写出3种即可)
(3)过程⑤的化学方程式为_________________________。
(4)从B溶液制备B的无水晶体的“操作a”为_____________________。
(5)过程③用SO2水溶液吸收溴单质,吸收率可达93%,生成两种强酸,写出反应的离子方程式 ______________________________。
(6)过程②到过程④的变化为“Br-→Br2→Br-→Br2”,其目的是_____ 。
查看答案和解析>>
科目: 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
下列表示氯及其化合物的化学用语正确的是
A.中子数为20的氯原子符号:20Cl
B.HClO的结构式:H—Cl—O
C.HClO4的电离方程式:HClO4 H++ClO4-
H++ClO4-
D.Cl-的结构示意图:
查看答案和解析>>
科目: 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,3.4gH2O2含有极性键的数目为0.2NA
B.1molCl2和足量氢氧化钠溶液充分反应,转移电子数目为2NA
C.电解精炼铜时,若转移了NA个电子,则阳极质量减小32g
D.标况下,11.2LSO3所含的分子数目为0.5NA
查看答案和解析>>
科目: 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
下列说法正确的是
A.氢气的燃烧热为△H=-285.5kJ•mol-1,则电解水的热化学方程式为2H2O(l) 2H2(g)+O2(g) △H=+285.5k•Jmol-1
2H2(g)+O2(g) △H=+285.5k•Jmol-1
B.反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) +3H2(g)═2NH3(g)△H=-38.6k•Jmol-1
D.由C(石墨,s)=C(金刚石,s) △H=+1.90 k•Jmol-1可知,金刚石比石墨稳定
查看答案和解析>>
科目: 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
已知NH4CuSO3与足量的5 mol•L-1硫酸溶液混合微热,产生下列现象::①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.据此判断下列说法正确的是
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.1mol NH4CuSO3完全反应转移0.5mol电子
查看答案和解析>>
科目: 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
2SO2(g)+O2(g) 2SO3(g) △H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是
2SO3(g) △H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是
A.甲和乙中反应的化学平衡常数相同
B.乙和丙中的二氧化硫的生成速率相同
C.乙中SO2的体积分数大于丙
D.转化率:α甲(SO2)+α乙(SO3)<1
查看答案和解析>>
科目: 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:填空题
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第__________周期,第________族;
(2)X可形成双原子分子,其分子的电子式是___________;Y和氢元素形成的10电子微粒中常见的+1价阳离子为_________(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为__________;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式______________________。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是_____________。
查看答案和解析>>
科目: 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:实验题
次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:

步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液.
步骤2:将装置A 中导气管换成橡皮塞.向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶.
(1)装置B 的烧杯中应加入的溶液是_________________;冷凝管中冷却水从__________(填“a”或“b”)口进水。
(2)A中多孔球泡的作用是_________________;
(3)写出步骤2中发生反应的化学方程式_________________;
(4)步骤3中在真空容器中蒸发浓缩的原因是是防止温度过高使产物分解,也防止_______________;
(5)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g。[M(NaHSO2·HCHO·2H2O)=154g/mol]
①如何检验沉淀是否洗净_____________________________。
②则所制得的产品的纯度为_____________。
查看答案和解析>>
科目: 来源:2016届黑龙江省高三上期末理综化学试卷(解析版) 题型:选择题
下列实验操作与实验目的或结论一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 取酸雨试样,加入10%H2O2溶液,再加入BaCl2溶液,有白色沉淀生成 | 该酸雨试样中一定含有H2SO4 |
B | 将锌片和银片用导线连接后同时插入盛有稀硫酸的烧杯中,银片表面产生大量气泡 | 形成的原电池中锌作负极,银作正极 |
C | 某无色溶液,加银氨溶液,水浴加热,有银镜生成 | 溶液中一定含有醛类化合物 |
D | 配制FeCl2溶液时,先将FeCl2溶于适量稀硝酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 | 抑制Fe 2+水解,并防止Fe 2+被氧化为Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com