
科目: 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
可使C(s)+ CO2(g)=2CO(g)反应速率增大的措施是( )
①增大压强 ②增加炭的量 ③通入CO2
④恒压下充入N2 ⑤恒容下充入N2 ⑥升温
A.①③④ B.②④⑥ C.①③⑥ D.③⑤⑥
查看答案和解析>>
科目: 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
高温下,某可逆反应达到平衡,其平衡常数为K=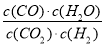 ,恒容时,升高温度,H2的浓度减小,则下列说法正确的是( )
,恒容时,升高温度,H2的浓度减小,则下列说法正确的是( )
A.该反应的焓变为正值
B.升高温度,K值减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
查看答案和解析>>
科目: 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
下列实验操作与预期实验目的或所得实验结论一致的是( )
选项 | 实验操作及现象 | 实验目的或结论 |
A | 向1,2两试管中分别加入等浓度H2O2溶液10 mL、1 mL,再向H2O2溶液中分别滴入等浓度等体积CuSO4、FeCl3溶液;试管2中产生气体较快 | 证明FeCl3溶液的催化效率更高 |
B | 硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
C | 测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明盐酸酸性比醋酸强 |
D | 取5 mL,0.1mol/L的AgNO3溶液于试管中,向试管中加入1-2滴0.1mol/L的NaCl溶液,出现白色沉淀,再向该试管中加入2滴0.1mol/L的KI溶液,出现黄色沉淀(AgI沉淀为黄色) | 证明: Ksp(AgI) <Ksp(AgCl) |
查看答案和解析>>
科目: 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
某温度下,向pH=6的纯水中加入NaHSO4 晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述中,不正确的是( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol/L
C.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性
D.NaHSO4晶体的加入抑制了水的电离
查看答案和解析>>
科目: 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:填空题
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9kJ/mol
(1)甲醇蒸气完全燃烧的热化学方程式为_____________________________。
(2)反应②中的能量变化如图所示,则ΔH2=_________________________。
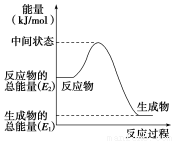
(3)H2(g)的燃烧热为____________________。
查看答案和解析>>
科目: 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:填空题
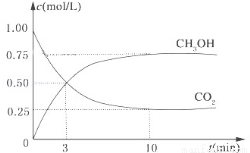
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min);
(2)氢气的转化率= _____;
(3)该反应的平衡常数为 _____(保留小数点后2位);
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 ___。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol H2
(5)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1 c2的关系(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:实验题
现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。

Ⅰ.实验步骤
(1)用________(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到
100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.100 0 mol/L NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为_______mL。
(4)滴定。当____________________________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积
V=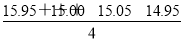 mL=15.24 mL
mL=15.24 mL
指出他的计算的不合理之处:______________________________________
按正确数据处理,可得c(市售白醋)=________mol/L;市售白醋总酸量________g/100 mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:选择题
某反应的反应过程中能量变化如右图所示。对该反应的有关叙述正确的是( )

A.该反应的正反应为放热反应
B.催化剂能改变反应的焓变
C.催化剂不能降低反应的活化能
D.逆反应的活化能小于正反应的活化能
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:选择题
将5.6g铁粉投入盛有100mL 2mol•L﹣1 稀硫酸的烧杯中,2min 时铁粉刚好溶解完全.如果反应前后溶液的体积不变,则该反应的平均速率可表示为( )
A.v(Fe)=0.5 mol•L﹣1•min﹣1 B. v(H2SO4)=1 mol•L﹣1•min﹣1
C.v(H2)=1 mol•L﹣1•min﹣1 D. v(FeSO4)=0.5 mol•L﹣1•min﹣1
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:选择题
德国哈伯发明以低成本制造大量氨的方法,流程图中为提高原料转化率而采取措施是( )

A.①②③ B.②④⑤ C.①③⑤ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com