
科目: 来源:2015-2016学年甘肃省高二上期末考试化学试卷(解析版) 题型:选择题
在由水电离产生的c(H+)=1×10–14mol/L的溶液中,一定可以大量共存的离子组是
A.K+、Ba2+、Cl–、NO3– B.Na+、Ca2+、I–、NO3–
C.NH4+、Al3+、Br–、SO42– D.K+、Na+、HCO3–、SO42–
查看答案和解析>>
科目: 来源:2015-2016学年甘肃省高二上期末考试化学试卷(解析版) 题型:选择题
关于小苏打水溶液的表述正确的是
A.存在电离只有HCO3— H+ + CO32—,H2O
H+ + CO32—,H2O  H+ + OH—
H+ + OH—
B.HCO3—的电离程度大于HCO3—的水解程度
C.c (Na+) + c (H+)= c (HCO3—)+ c (CO32—)+ c (OH—)
D.c (Na+) = c (HCO3—)+ c (CO32—)+ c (H2CO3)
查看答案和解析>>
科目: 来源:2015-2016学年甘肃省高二上期末考试化学试卷(解析版) 题型:选择题
煤炭、一氧化碳、氢气都是重要能源,已知:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②H2(g)+ 1/2O2(g) =H2O(g) ΔH2=-241.6 kJ·mol-1
③CO(g)+1/2O2(g) =CO2(g) ΔH3=-283.0 kJ·mol-1
④H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1
下列说法合理的是
A.氢气的燃烧热ΔH=-241.6 kJ·mol-1
B.等质量的H2、CO完全燃烧时,CO释放的热量更多
C.煤的气化的热化学方程式为C(s)+H2O(g)=CO(g)+ H2(g) ΔH=-131.1 kJ·mol-1
D.煤炭完全燃烧释放1967.5 kJ热量时转移20 mol电子
查看答案和解析>>
科目: 来源:2015-2016学年甘肃省高二上期末考试化学试卷(解析版) 题型:选择题
炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2 L的密闭容器中,高温下进行下列反应:C(s)+CO2(g) =2CO(g) ΔH=Q kJ·mol-1。下图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是

A.0~1 min,v(CO)=1 mol·L-1·min-1;1~3 min,v(CO)=v(CO2)
B.当容器内的压强不变时,反应一定达到平衡状态,P(平衡) /P(起始) < 1
C.3 min时,温度由T1升高到T2,则Q>0,再达平衡时,K(T2)/ K(T1)> 1
D.5 min时再充入一定量的CO,a、b曲线分别表示n(CO)、n(CO2)的变化
查看答案和解析>>
科目: 来源:2015-2016学年甘肃省高二上期末考试化学试卷(解析版) 题型:简答题
有可逆反应Fe(s)+CO2(g)  FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了 C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_____________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式______________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=______________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。

①升高温度________________;②再通入CO_________________。
(5)该反应的逆反应速率随时间变化的关系如图:
①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)
__ ___。(单选)
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线
查看答案和解析>>
科目: 来源:2016届西藏日喀则高级中学高三上期末理综化学试卷(解析版) 题型:选择题
下列判断错误的是( )
A.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合,生成白色沉淀:Ba2++SO42-+H++OH-=BaSO4↓+H2O
B.常温下,等物质的量浓度的三种溶液①(NH4)2CO3②NH4Cl③(NH4)2Fe(SO4)2中c(NH4+):①<②<③
C.加入苯酚显紫色的溶液中:K+、NH4+、Cl-、I-四种离子不能大量共存
D.c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+四种离子可以大量共存
查看答案和解析>>
科目: 来源:2016届西藏日喀则高级中学高三上期末理综化学试卷(解析版) 题型:选择题
根据下列框图,有关说法正确的是( )
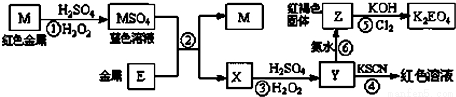
A.M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱
B.反应⑤的离子方程式可表示为:2E(OH)3+3Cl2+6H2O═3EO42-+6Cl-+12H+
C.反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性
D.用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42-+4H2O+3e-═E(OH)3+5OH-
查看答案和解析>>
科目: 来源:2016届西藏日喀则高级中学高三上期末理综化学试卷(解析版) 题型:实验题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①4FeO•Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3  2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
③Cr2CO72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有______________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用_____________________(填写仪器或试剂名称);
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_____________________;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、________、过滤、_______、干燥;
(4)如表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7+2NaCl,该反应在溶液中能发生的理由是_____________________;
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量________(填写试剂)、溶解、过滤、再质量分数为________(填写试剂)、…灼烧、冷却、称量,得干燥固体mg.计算祥品中氢氧化铝的________(用含m、n的代数式表示)。
查看答案和解析>>
科目: 来源:2016届西藏日喀则高级中学高三上期末理综化学试卷(解析版) 题型:推断题
[化学选修5—有机化学基础]
药物菲那西洒汀的一种合成路线如下:

(1)菲那西汀的分子式 _____________________;
(2)①~⑥反应过程中在苯环上发生取代反应的是_____________________;
(3)反应②中生成的无机物的化学式为 _____________________;
(4)写出⑤反应的化学方程_____________________;
(5)菲那西汀水解的化学方程式是_____________________;
(6)菲那西汀的同分异构体中,符合下列条件的共有_______种;
①含苯环且只有对位两个取代基②苯环上含有氨基③能水解,水解产物能发生银镜反应
(7)菲那西汀的同分异构体中,含苯环且只有对位两个取代基,两个取代基含有相同碳原子数,且含 有α-氨基酸结构,写出这种同分异构体缩聚后高分子产物的结构简式_____________________。
查看答案和解析>>
科目: 来源:2016届陕西省高三上期末化学试卷(解析版) 题型:选择题
某温度下,饱和石灰水的溶解度为Sg,密度为ρg/mL,向足量该饱和溶液中加入mgCaO,充分作用后,恢复到原来温度,下列有关说法不正确的是( )
A.最终得到沉淀的质量大于 37m/28g
B.该饱和溶液质量百分比浓度为 s/(100+s)%
C.最终所得溶液PH不变
D.该饱和溶液中溶质物质的量浓度为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com