
科目: 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:选择题
短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:下列说法正确的是( )
①R、Y原子的最外层电子数与电子层数相同;
②Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;
③W与R同主族.
A. T、Q、W、Y的原子半径大小为:T<Q<Y<W
B. Q与W形成的两种常见化合物中含有相同比例的阴、阳离子,属于同种晶体类型
C. Q与Y组成的常见物质是一种碱性氧化物
D. 由Y和T组成的物质YT是原子晶体,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.如果某化合物只含共价键,则其一定是共价化合物
B.H2O2是由极性共价键和非极性共价键构成的非极性分子
C.两种酸溶液充分反应后的体系不可能为中性
D.碳、氮形成的氢化物常温下都是气态
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.用乙醇或CCl4提取碘水中的碘单质
B.NaCl和SiC晶体熔化时,克服粒子间作用力类型相同
C.24Mg32S晶体中电子总数与中子总数之比为1:1
D.H2S与SiF4分子中各原子最外层都满足8电子结构
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:选择题
下列关于晶体的说法一定正确的是( )
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2﹣相紧邻
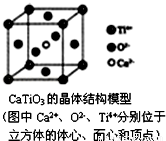
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:选择题
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4]2+
C.向反应后的溶液加入乙醇,溶液将会没有发生任何变化,因[Cu(NH3)4]2+不会与乙醇发生反应
D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:选择题
下列分子中,各原子均处于同一平面上的是( )
A.NH3 B.CCl4 C.H3O+ D.CH2O
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:选择题
BF3与一定量的水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R:
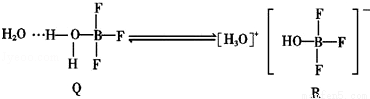
反应过程中新形成的化学键中无( )
A.离子键 B.配位键 C.非极性共价键 D.氢键
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:填空题
A,B,C,D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C、形成10电子总数相等的多原子分子M、N、W,且在M、N、W分子中,A、B、C原子都采取sp3杂化.
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示).A22﹣与C22+互为等电子体,C22+的电子式
②N的沸点比其同族相邻氢化物沸点高的主要原因是 .W分子的空间构型的名称是
(2)E、F、G三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1.
①F元素基态原子电子排布式为
②E元素单质的晶体堆积模型为 (填字母)

③向G的硫酸盐溶液中通入过量N气体,可生成[G(N)4]2+不考虑空间构型,[G(N)4]2+的结构可用示意图表示为 (用元素符号表示).
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:填空题
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B﹣少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A+与D2﹣离子数之比为2:1.请回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于 (填写“六方”、“面心立方”或“体心立方”).
(2)B﹣的价电子排布图为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化.
(3)C的氢化物的空间构型为
(4)B元素的电负性 D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: .
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为 a cm.试计算R晶体的密度为  g/cm3 .(阿伏加德罗常数用 NA表示)
g/cm3 .(阿伏加德罗常数用 NA表示)
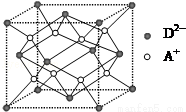
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:填空题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
B元素原子的核外p电子数比s电子数少1
C原子的第一至第四电离能分别是:
I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol
D原子核外所有p轨道全满或半满
E元素的主族序数与周期数的差为4
F 是前四周期原子电子轨道表示式中单电子数最多的元素
G在周期表的第十一列
(1)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形.
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是 .
(3)①DE3中心原子的杂化方式为 杂化,该分子中的键角比离子DE4+中的键角小的原因是
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+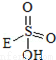 → +HE (请写出横线上物质的结构式)
→ +HE (请写出横线上物质的结构式)
(4)F位于 区,价电子排布式为 .
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为 .假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为 .

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com