
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )
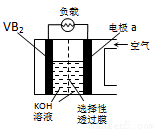
A.电极a为电池负极
B.图中选择性透过膜只能让阳离子选择性透过
C.电子由VB2极经KOH溶液流向a电极
D.VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.硫酸工业中二氧化硫的催化氧化[2SO2(g)+O2(g) 2SO3(g)],不采用高压是因为压强对SO2转化率无影响
2SO3(g)],不采用高压是因为压强对SO2转化率无影响
B.同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同
C.3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0
D.合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是( )
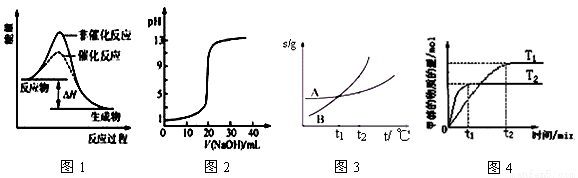
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1000 mol•L-1NaOH溶液滴定20.00mL0.1000 mol•L-1CH3COOH溶液所得到的滴定曲线
C.图3表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B=A
D.图4表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盐酸酸化的Ba(NO3)2溶液中通入SO2 | 有白色沉淀生成 | BaSO3难溶于酸 |
B | 向溶液X中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
C | 向FeBr2溶液中加入少量氯水,再加CCl4萃取 | CCl4层无色 | Fe2+的还原性强于Br- |
D | 向亚硫酸钠溶液中滴加盐酸 | 有气体产生 | 非金属性Cl>S |
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
温度为T时,向2.0L恒容密闭容器中充入2.0mol NO2,反应2NO2(g)  N2O4(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:
N2O4(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(N2O4)/mol | 0 | 0.12 | 0.18 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s的平均速率为v(NO2)=0.001 2 mol•L-1•s-1
B.保持温度不变,向平衡后的容器中充入1.0 mol N2O4时,v(正)<v(逆)
C.保持其他条件不变,升高温度达到新平衡时K=0.125,则反应的△H<0
D.T温度时,若起始向容器中充入2.0 mol N2O4,则平衡时N2O4的转化率大于80%
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
下列溶液中微粒的物质的量浓度关系正确的是
A.常温下0.1 mol/L的下列溶液① NH4Al(SO4)2、② NH4Cl、③ NH3·H2O、④ CH3COONH4溶液中,c(NH4+)由大到小的顺序是②>①>④>③
B.常温下0.4 mol/L CH3COOH溶液和0.2 mol/L NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度大小顺序为:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.0.1 mol/L(NH4)2Fe(SO4)2溶液:c(NH4+)+c(NH3·H2O)+ c(Fe2+)=0.3 mol/L
D.室温下,向0.1 mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-) = c(H+)
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:填空题
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示.回答下列问题:
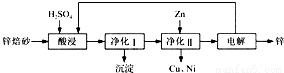
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为____________;
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀.
①写出酸性条件下H2O2与Fe 2+反应的离子方程式:____________;
②25℃时,pH=3的溶液中,c(Fe3+)= ____________mol•L-1(已知25℃,Ksp[Fe( OH)3]=4.0×10-38).
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________;
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是____________;
(4)本流程中可以循环利用的物质除锌外还有____________。
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:实验题
硫酸钠-过氧化氢加合物(xNa2SO4•yH2O2•zH2O)的组成可通过下列实验测定:
①准确称取1.7700g 样品,配制成100.00mL 溶液A.
②准确量取25.00mL 溶液A,加入盐酸酸化的BaCl2 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g.
③准确量取25.00mL 溶液A,加适量稀硫酸酸化后,用0.02000mol•L-1KMnO4 溶液滴定至终点,消耗KMnO4 溶液25.00mL.H2O2 与KMnO4 反应的离子方程式如下:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)步骤②中滴定终点的现象为____________;
(2)步骤②中使用盐酸酸化,而步骤③中改用硫酸酸化的原因是____________;
(3)上述滴定若不加稀硫酸酸化,MnO4-被还原为MnO2,其离子方程式为____________;
(4)通过计算确定样品的组成(写出计算过程)。
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:填空题
氨气在生产、生活和科研中应用十分广泛。
(1)①SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),SNCR-SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g) 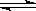 4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1;
4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1;
6NO(g)+4NH3(g) 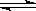 5N2(g)+6H2O(g)△H=-1807.0kJ•mol-1;
5N2(g)+6H2O(g)△H=-1807.0kJ•mol-1;
6NO2(g)+8NH3(g) 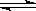 7N2(g)+12H2O(g)△H=-2659.9kJ•mol-1;
7N2(g)+12H2O(g)△H=-2659.9kJ•mol-1;
反应N2(g)+O2(g) 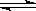 2NO(g)的△H= ____________ kJ•mol-1
2NO(g)的△H= ____________ kJ•mol-1
②液氨可以发生电离:2NH3(l) 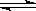 NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式____________;
NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式____________;
(2)氨气易液化,便于储运①若在恒温恒容的容器内进行反应2NH3(g) 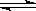 N2(g)+3H2(g);△H=+94.4kJ/mol,下列表示该反应达到平衡状态的标志有____________(填字母序号)
N2(g)+3H2(g);△H=+94.4kJ/mol,下列表示该反应达到平衡状态的标志有____________(填字母序号)
A.容器中混合气体的密度保持不变
B.NH3(g)百分含量保持不变
C.容器中混合气体的压强保持不变
D.有3个H-H键生成同时又1个N≡N键生成
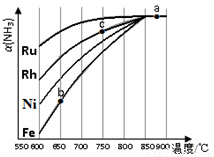
②其他条件相同时,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度的变化如图所示.在600℃时催化效果最好的是____________(填催化剂的化学式).c点氨气的转化率高于b点,原因是____________。
(3)如图表示使用新型电极材料,以N2、H2 为电极反应物,以HCl-NH4Cl为电解质溶液组成的既能提供能量又能实现氮固定的新型电池。请写出该电池的正极反应式____________;生产中可分离出的物质A的化学式为____________。
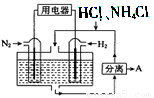
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:填空题
氮元素可形成卤化物、叠氮化物及配合物等
(1)在铜催化作用下F2和过量NH3反应得到NF3,其构型为三角锥形,沸点-129℃,则NF3属于____________晶体。
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-.
①与N3-互为等电子体的分子有:____________(举1例),由此可推知N3-的空间构型是____________型;
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co(N3)(NH3)5]SO4、Fe(CN)64-。写出钴原子在基态时的价电子排布式:____________ ;[Co(N3)(NH3)5]SO4中钴的配位数为____________;CN-中C原子的杂化类型是____________;
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是____________(选填序号)
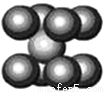
A.NaN3与KN3结构类似,前者晶格能较小
B.第一电离能(I1):N>P>S
C.钠晶胞结构如图,该晶胞分摊2个钠原子
D.氮气常温下很稳定,是因为氮的电负性大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com