
科目: 来源:2015-2016学年江苏省高二下学期期末化学试卷(解析版) 题型:选择题
将3.2 g Cu跟30.0 mL 10.0 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO的物质的量为
A.0.5a mol B.(0.1+a)mol C.0.1a mol D.2a mol
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期期末化学试卷(解析版) 题型:填空题
Al及Al的合金在生活生产中有着广泛的应用
(1)航母升降机可由铝合金制造。
①Al元素在周期表中的位置是 ;
②Al—Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为: 。
(2)2015年11月首架C919大飞机总装下线,标志着我国跻身飞机研制先进国家行列。机身蒙皮使用的是第三代铝锂合金材料。下列不属于铝锂合金性质的是 (填字母)。
a.密度大 b.硬度大 c.抗腐蚀
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性 (选填“强”“弱”)。
利用上述方法可制取Ba的主要原因是 。
a.高温时Al的活泼性大于Ba
b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定
d.Ba的沸点比Al的低
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期期末化学试卷(解析版) 题型:推断题
下列A~I九种物质之间的转化关系如图所示,其中部分生成物或反应条件已略去。已知A在常温下为黑色固体单质,常温下C、E、F都是无色气体。

请回答下列问题:
(1)C的固体名称________,F的化学式是________。
(2) B的浓溶液与A反应过程中,B体现的性质与下列反应中HNO3体现的性质完全相同的是_____。
A.C+4HNO3(浓) CO2+4NO2↑+2H2O
CO2+4NO2↑+2H2O
B.3Fe+8HNO3(稀 )=3Fe(NO3 )2+2NO↑+4H2O
C.Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
D.2Fe2O3+6HNO3===2Fe(NO3)3+3H2O
(3)A与B反应的化学方程式是____________。
(4)G与H反应的离子方程式是_________________________;
C与淡黄色固体反应生成F与G的化学方程式__________________________。
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期期末化学试卷(解析版) 题型:填空题
硅是人类文明发展的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)工业生产粗硅的反应有:SiO2+2C Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
(2)工业上可以通过如下图所示的流程制取纯硅:
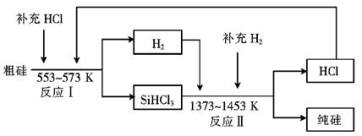
①若反应I为 Si(粗)+3HCl SiHCl3+H2,则反应II的化学方程式为 。
SiHCl3+H2,则反应II的化学方程式为 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式: 。
③设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期期末化学试卷(解析版) 题型:实验题
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程。
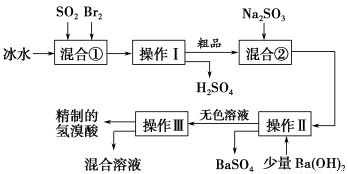
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为________________________________。
(2)混合①中使用冰水的目的是________________________________。
(3)操作Ⅱ和操作Ⅲ的名称分别是________、________。
(4)混合液②中加入Na2SO3的目的是_________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察的现象为___________。乙同学假设工业氢溴酸呈淡黄色是因为________________________,其用于证明该假设所用的试剂为________。
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期期末化学试卷(解析版) 题型:实验题
(1)实验室用金属铜和稀硝酸制取NO的离子方程式:____________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图Ⅰ所示。
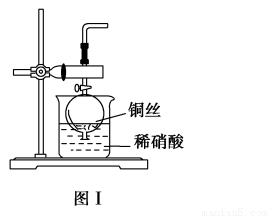

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这丝状材料的成分可以是________(填选项编号)。
A.铁 B.铝 C.银 D.玻璃 E.聚丙烯塑料
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是_________(填化学方程式)
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某同学另设计了一套如图Ⅱ所示制取NO的装置。反应开始后,可以在U形管右端观察到无色的NO气体。
①漏斗的作用是_____________________________________________________。
②让反应停止的操作方法及原因是________________________________________。
(4)以下收集NO气体的装置(见图Ⅲ),合理的是________(填选项代号)。
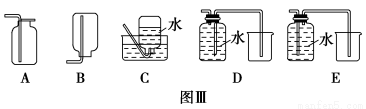
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期期末化学试卷(解析版) 题型:实验题
亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:


查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如右图是所示。
(1)右图中的线2表示的组分为 (填化学式)。
(2)实验时,“反应II”中加入NaOH溶液的目的是 (用化学方程式表示)。
(3)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了两种方法进行测定。
①方法I:称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后称量,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)
②方法II:称取1.326g产品,配成100mL溶液,取25.00mL该溶液,滴加0.1250mol/L I2溶液,恰好使Na2SO3完全氧化生成Na2SO4时,消耗I2溶液20.00mL。通过计算确定产品中Na2SO3的质量分数(写出计算过程)
③判断Na2SO3产品的等级,并说明理由。
查看答案和解析>>
科目: 来源:2014-2015学年宁夏高二上学期期中化学试卷(解析版) 题型:选择题
有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是 ( )
A. HF B. H3O+ C. NaH D. H2O2
查看答案和解析>>
科目: 来源:2014-2015学年宁夏高二上学期期中化学试卷(解析版) 题型:选择题
下列各组元素中,电负性依次减小的是 ( )
A. K、Na、Al B. O、Cl、H C. As、P、H D. O、S、Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com