
科目: 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:选择题
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如右图所示的实验,发现烧杯中溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是( )
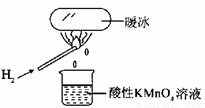
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.水凝固形成20~C时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:选择题
通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能,键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的(△H)等于反应物的总键能与生成物的总键能之差。
化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)  si(s)+4HCl(g),该反应的反应热AH为 ( )
si(s)+4HCl(g),该反应的反应热AH为 ( )
A.+412 kJ•mol-1 B.一412 kJ•mol-1
C.+236 kJ•mol-1 D.一236 kJ•mol-1
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:选择题
短周期元素M、W、X、Y、Z的原子序数依次增大,M元素的一种核素没有中子,且M、W、X、Y+、Z的最外层电子数与其电子层数的比值依次为1、2、3、4、2(不考虑零族元素),下列关于这些元素的叙述正确的是( )
A. X分别和其它四种元素均可形成至少2种化合物
B. M分别和w、X、Y、Z形成化合物,均显相同化合价
C. M、X、Z三种元素组成的化合物含有离子键
D. M、X、Y组成化合物和Y、Z组成化合物,它们所含的化学键类型完全相同
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:选择题
短周期原子序数依次增大的主族元素R、T、Q、w、Y具有如下信息:①R、Y原子的最外层电子数与电子层数相同;@Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;③w与R同主旅。下列说法正确的是 ( )
A. T、Q、w、Y的原子半径大小为:T<Q<Y<w
B. Q与w形成的两种常见化合物中含有相同比例的阴、阳离子,属于同种晶体类型
C. Q与Y组成的常见物质是一种碱性氧化物
D. 由Y和T组成的物质YT是原子晶体,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:实验题
某小组用0.50 mol·L—1NaOH溶液和0.50 mol·L—1硫酸溶液进行中和热的测定。
I.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mLNaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是__________(填字母):
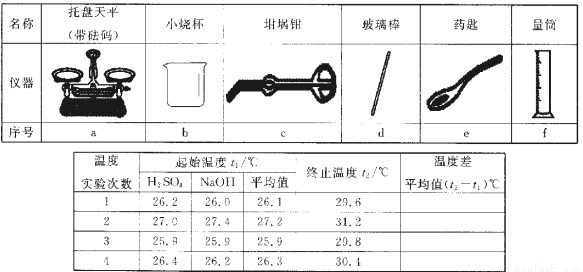
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
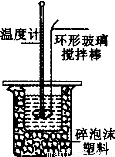
(3)取50 mI。NaOH溶液和30 mL硫酸溶液进行实验,实验数据如上表。
①上表中的温度差平均值为 ℃;
②近似认为0.50 mol/L NaOH溶液和O.50mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热△H (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol叫有偏差,产生偏差的原因可能是——(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H。SO。溶液的温度
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:填空题
I.下表为周期表的一部分,其中的编号代表对应的元素。

(1)写出上表中元素I的价层电子排布图 。元素C、D、E、F的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有( )
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)的配位化合物,该物质常温下呈液态,熔点为一20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断:该化合物的晶体中存在的作用力有( )
A.离子键
B.极性键
C.非极性键
D.范德华力
E.氢键
F.配位键
Ⅱ.(1) BCl3中B原子的杂化方式为 。第一电离能介于B、N之间的第二周期元素有 种。写出与BCl3结构相同的一种等电子体 (写离子)。
(2)科学家测得胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
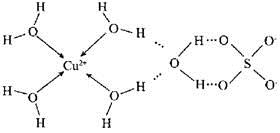
①胆矾的化学式用配合物的形式表示为的 ;
②胆矾中SO42-的空间构型为 。
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:填空题
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是( )
a.HCl、HBr、HI水溶液的酸性
b.Cl2、Br2、I2的熔点
c.HCl、HBr、HI的热稳定性
d.Cl2、Br2、I2的氧化性
(3)工业上,通过如下转化可制得KCl03晶体:

②Ⅱ反应过程能析出KCIO3晶体而无其他晶体析出的原因是
(4)一定条件下,在水溶液中1mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。

①D是_________(填离子符号)。
②B→A+c反应的热化学方程式为___________(用离子符号表示)。
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:填空题
(1)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是 (填化学式)。

(2)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(3)氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______ 个铜原子。
(4)很多金属盐都可以发生焰色反应,其原因是
(5) 已知HF与F-通过氢键结合成HF2-.判断HF2-和HF2-微粒间能否形成氢键,并说明理由.
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:填空题
磷单质及其化合物在工业生产巾有着广泛的应用。向磷可用于制备高纯度的磷酸(磷酸结构简式为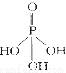 ),三聚磷酸钠是常用的水处理剂,次磷酸钠(Nail2P@)可用于化学镀镍等等。完成下列填空:
),三聚磷酸钠是常用的水处理剂,次磷酸钠(Nail2P@)可用于化学镀镍等等。完成下列填空:
(1)磷元素原子核外最外层电子排布式为 。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 (填元素符号)。
(2)氧原子核外有 种不同能量的电子。
(3)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图。
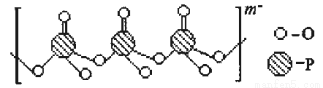
①磷原子的杂化类型为 ;②这种多聚磷酸钠的化学式为
(4) 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性
①NaH2PO2为 (填“正盐”或“酸式盐”),其溶液显 (填“弱酸性”“中性”或“弱碱性”)
②次磷酸钠(NaH2PO2)可用于化学镀镍.化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应生成Ni和H2PO3-,写出上述反应离子方程式
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:填空题
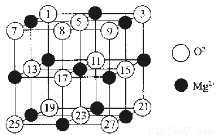
(1)已知MgO的晶体结构属于NaCl型,MgO晶胞中Mg2+的配位数为 ;与( )距离最近的( )有 个,某同学画出的MgO晶胞结构示意图如图所示,请指出其中错误的是 ( )
(2)铝单质的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图丙所示。
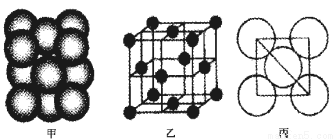
若已知铝原子半径为d cm,NA表示阿伏加德罗常数,铝的摩尔质量为M g/mol,则该晶体的密度可表示为 g/cm3。(填化简结果)。
(3)氢能被视作连接化石能源和可再生能源的重要桥梁;氢的规模化储运是氢能应用的关键。氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料。请写出含有配位键(用“→”表示)的氨硼烷的结构式 ;与氨硼烷互为等电子体的有机小分子是 (写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com