
科目: 来源:2015-2016学年江苏省高二下学期第二次月考化学试卷(解析版) 题型:选择题
Y是一种皮肤病用药,它可以由原料X经过多步反应合成。

下列说法正确的是
A.X与Y互为同分异构体
B.1mol X最多可以与5mol H2发生加成反应
C.产物Y能发生氧化、加成、取代、消去反应
D.1 molY最多能与2mol NaOH发生反应
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期第二次月考化学试卷(解析版) 题型:选择题
含氮废水在排入水体之前需进行脱氮处理以减缓水体富营养化。某化肥厂废水中NH4+的浓度为54mg/L,在微生物作用的条件下脱氮处理:
①NH4++ O2 — NO2-+ H++ H2O(未配平)
②2NO2-+ O2=2NO3-
③6NO3-+5CH3OH+6H+=3N2 + 5X+ 13H2O
下列说法中正确的是
A.反应①配平后,H2O的化学计量数为4
B.若反应②有2mol电子发生转移,则生成1molNO3-
C.反应③中生成物X为CO32-
D.1L废水完全脱氮所需CH3OH的质量为0.08g
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期第二次月考化学试卷(解析版) 题型:选择题
以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤。相关物质的溶解度曲线如图所示。下列说法不正确的是

A.将NaHCO3加热分解可得纯碱
B.常温下碳酸氢钠的溶解度大于碳酸钠
C.采用蒸发结晶从溶液中分离出NaHCO3
D.20℃时,NaHCO3饱和溶液的物质的量浓度约为1.1mol/L
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列实验的解释或结论正确的是
选项 | 实验 | 解释或结论 |
A | 向包有Na2O2的脱脂棉滴少量水,脱脂棉燃烧 | Na2O2与H2O反应放热并有O2生成 |
B | 向NaI溶液滴加FeCl3溶液,再加入CCl4,振荡,静置,下层呈紫红色 | 氧化性:I2>Fe3+ |
C | 取酸雨试样,滴加H2O2溶液,再加入BaCl2溶液,有白色沉淀 | 该酸雨试样中一定含有H2SO3 |
D | 用激光笔照射水玻璃(Na2SiO3的溶液),有丁达尔现象 | SiO32-水解生成了硅酸胶体 |
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期第二次月考化学试卷(解析版) 题型:选择题
将FeO与Cu(NO3)2的混合物9.08g全部溶于300mL、1mol/L的盐酸中,有部分Fe2+被酸性条件下的NO3-氧化(其化学反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O),放出NO气体448mL(标准状况);继续向溶液中通入一定量的Cl2恰好将溶液中的Fe2+完全氧化;再加入10g过量的铁粉,充分反应放出H2,过滤,得到不溶固体。下列叙述不正确的是
A.Cu(NO3)2的物质的量为0.01mol
B.通入Cl2的体积(标准状况)为448mL
C.放出H2的体积(标准状况)为112mL
D.得到不溶固体的质量为6.72g
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期第二次月考化学试卷(解析版) 题型:填空题
有机物J是我国食品添加剂使用卫生标准规定允许使用的食品香料,香气强度为普通香料的3~4倍。有机物J的合成路线如下图
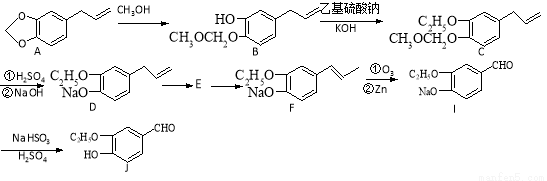
(1)该香料包装袋打开后需要尽快使用的原因是 。
(2)由D到 F需要先后经过的反应类型为 。
(3)可以用来检验F→I合成过程中生成了有机物I的方程式: 。
(4)J的一种同分异构体K,能与NaHCO3反应,在浓硫酸加热情况下可失去一分子水后能形成L或M,L中除苯环外还有一个六元环,而M能使溴水褪色。写出K的结构简式 。
(5)已知: 利用题目所给信息设计由
利用题目所给信息设计由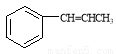 合成
合成 合成路线流程图示例如下:
合成路线流程图示例如下:
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期第二次月考化学试卷(解析版) 题型:填空题
硝酸铝是一种常见常见媒染剂。工业上用含铝废料(主要含Al、Al2O3、Fe3O4、SiO2等)制取硝酸铝晶体[Al(NO3)3·9H2O]及铝单质的流程如下:

(1)写出反应Ⅰ中Fe3O4参加反应的离子方程式: 。
(2)写出反应Ⅱ的离子方程式: 。
(3)该流程中有一处设计不合理,请指出并加以改正: 。
(4)写出反应Ⅵ的化学方程式: 。
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期第二次月考化学试卷(解析版) 题型:实验题
为回收利用废钒催化剂(含有V2O5、VOSO4及SiO2等,其中VOSO4可溶于水),科研人员最新研制了一种回收钒的新工艺,其主要流程如下:
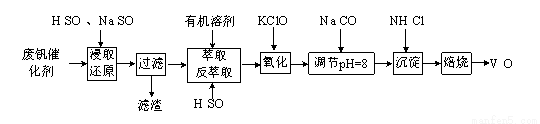
(1)萃取、反萃取过程中所需的主要玻璃仪器为 。
(2)上述流程中涉及到两处氧化还原反应。
①“浸取还原”过程的产物为VOSO4,该反应的离子方程式为 。
②“氧化”过程无气体产生,溶液中VO2+转化为VO2+,该反应的离子方程式为 。
(3)“沉淀”过程中,沉钒率受温度、氯化铵系数(NH4Cl的质量与调节pH之后的料液中VO的质量比)等的影响,其中温度与沉淀率的关系如图所示,温度高于80℃沉钒率降低的可能原因是 。

(4)上述流程中所得沉淀为一系列的聚合物种[其分子组成可用NmHnVxOy表示],质谱法分析某沉淀的摩尔质量为832g/mol。取该沉淀83.2g用下列装置测定其组成,充分焙烧后玻璃管内残留V2O5固体为72.8g;所得气体通过U形管后,U形管增重3.6g。
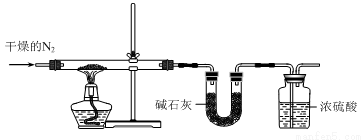
①广口瓶中浓硫酸的作用为 。
②该沉淀的分子式为 。
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期第二次月考化学试卷(解析版) 题型:填空题
某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及MgO。实验小组设计如下流程用其制备碱式硫酸铝[Al2(OH)4SO4]:
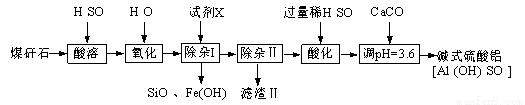
(1)为提高“酸浸”时铝浸出率,可采取的措施之一是 。
(2)氧化时应控制反应温度在10℃~20℃,其原因是 ,“氧化”时可用MnO2替代,发生的离子方程式 。
(3)试剂X为 ,设计一个简单的实验,证明铁元素已被沉淀完全: 。
(4)加入CaCO3制备碱式硫酸铝的化学方程式 。
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下学期第二次月考化学试卷(解析版) 题型:填空题
高锰酸钾在酸性介质中的强氧化性广泛应用于分析化学之中。如利用KMnO4 标准溶液测定C2O42—的物质的量浓度,其反应原理如下:5C2O42- + 2MnO4-+16H+ +4H2O=2[Mn(H2O)6]2+ +10CO2↑
(1)Mn2+基态的核外电子排布式可表示为 ;
(2)C2O42—离子中C原子轨道杂化类型为 ;1mol [Mn(H2O)6]2+中所含有的σ键数目为 。
(3)与CO2互为等电子体的一种阴离子为 (填化学式);常温下CO2呈气态,而H2O呈液态,其主要原因为 。
(4)将KMnO4在空气中焙烧可制得Mn3O4,Mn3O4中Mn元素的化合价为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com