
科目: 来源:2016届广西柳州铁路一中高三5月月考理科化学试卷(解析版) 题型:选择题
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖。青蒿素的结构如图所示,下列关于青蒿素的说法错误的是

A.青蒿素的化学式为C15H22O5
B.青蒿素的同分异构体中可能有芳香族化合物
C.青蒿素可与NaOH溶液发生水解反应
D.青蒿素可用蒸馏水从植物提取
查看答案和解析>>
科目: 来源:2016届广西柳州铁路一中高三5月月考理科化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的值,下列叙述正确的是
A.60g丙醇中存在的共价键总数为10NA
B.1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C.钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为1NA
D.235g U发生裂变反应:
U发生裂变反应: U+
U+ n
n
 Sr+
Sr+ U+10
U+10 n净产生的中子(
n净产生的中子( n)数为10NA
n)数为10NA
查看答案和解析>>
科目: 来源:2016届广西柳州铁路一中高三5月月考理科化学试卷(解析版) 题型:选择题
某溶液中含有 NH4+ 、SO32-、SiO32- 、Br-、CO32- 、Na+,向该溶液中通入过量的Cl2,则下列判断正确的是
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+;②有胶状物质生成;③有气体产生④溶液颜色发生变化;⑤共发生了2个氧化还原反应
A.仅①②③④ B.仅②③④ C.仅①③⑤ D.仅②④⑤
查看答案和解析>>
科目: 来源:2016届广西柳州铁路一中高三5月月考理科化学试卷(解析版) 题型:选择题
用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4 2Pb(BF4)
2Pb(BF4) 2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A.放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O
B.充电时,当阳极质量增加23.9 g时,溶液中有0.2 mol电子通过
C.放电时,正极区pH增大
D.充电时,Pb电极与电源的正极相连
查看答案和解析>>
科目: 来源:2016届广西柳州铁路一中高三5月月考理科化学试卷(解析版) 题型:选择题
1mol分子式为C7H12O4的酯在氢氧化钠溶液、加热条件下完全水解生成1mol羧酸钠和2mol甲醇,则符合该条件的酯的结构有
A.4种 B.5种 C.6种 D.7种
查看答案和解析>>
科目: 来源:2016届广西柳州铁路一中高三5月月考理科化学试卷(解析版) 题型:简答题
甲醇燃料分为甲醇汽油和甲醇柴油,工业合成甲醇的方法很多。
(1)一定条件下发生反应:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1
2CO(g)+O2(g)═2CO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则CO(g)+2H2(g)?CH3OH(g)的△H═ _________.
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图1所示,该反应的△H____0 (填>、<或=).
(3)若要提高甲醇的产率,可采取的措施有(填字母)___________
A.缩小容器体积
B.降低温度
C.升高温度
D.使用合适的催化剂
E.将甲醇从混合体系中分离出来

(4)CH4和H2O在催化剂表面发生反应CH4+H2O?CO+3H2,T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,计算该温度下上述反应的化学平衡常数_____________________(结果保留小数点后两位数字)
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图2是目前研究较多的一类固体氧化物燃料电池工作原理示意图,B极的电极反应式为_________
(6)25℃时,草酸钙的Ksp=4.0×10﹣8,碳酸钙的Ksp=2.5×10﹣9。向10ml碳酸钙的饱和溶液中逐滴加入8.0×10﹣4mol•L﹣1的草酸钾溶液10ml,能否产生沉淀__________(填“能”或“否”).
查看答案和解析>>
科目: 来源:2016届广西柳州铁路一中高三5月月考理科化学试卷(解析版) 题型:实验题
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:①2NO+Na2O2=2NaNO2 ②2NO2+Na2O2=2NaNO3③酸性KMnO4溶液可将NO2﹣氧化为NO3﹣,MnO4﹣还原成Mn2+。
Ⅰ.产品制备与检验:用如图1装置制备NaNO2:
(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目__________
(2)B装置的作用是_______
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有硝酸钠、碳酸钠、氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在右框内画出增加的装置图2,并标明盛放的试剂.
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)_____________________
Ⅱ.含量的测定
称取装置C中反应后的固体4.00g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

(5)第一组实验数据出 现异常,造成这种异常的原因可能是________(双项选择)。
现异常,造成这种异常的原因可能是________(双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定结束仰视读数
D.滴定结束俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数________(结果保留4位有效数字)
查看答案和解析>>
科目: 来源:2016届广西柳州铁路一中高三5月月考理科化学试卷(解析版) 题型:简答题
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表 示固相中氢原子与金属原子的个数比(H/M)。在O
示固相中氢原子与金属原子的个数比(H/M)。在O A段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+ H
A段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+ H (g)==zMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=_____(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=______mL•g-1•min-1。反应的焓变△H(Ⅰ)_____0(填“>”“<”或“=”)
(g)==zMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=_____(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=______mL•g-1•min-1。反应的焓变△H(Ⅰ)_____0(填“>”“<”或“=”)
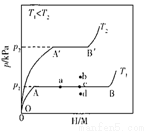
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1 )____ η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的_____点(填“b”“c”或“d”),该贮氢合金可通过________或________的方式释放氢气。
)____ η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的_____点(填“b”“c”或“d”),该贮氢合金可通过________或________的方式释放氢气。
(3)贮氢合金ThNi5可催化由CO、H 合成CH
合成CH 的反应,温度为T时,该反应的热化学方程式为_______ 。已知温度为T时:CH
的反应,温度为T时,该反应的热化学方程式为_______ 。已知温度为T时:CH (g)+2H2O=CO
(g)+2H2O=CO (g)+4H
(g)+4H (g) △H=+165KJ•mol?1
(g) △H=+165KJ•mol?1
CO(g)+H2O(g)=CO (g)+H
(g)+H (g) △H=-41KJ•mol?1
(g) △H=-41KJ•mol?1
查看答案和解析>>
科目: 来源:2016届广西柳州铁路一中高三5月月考理科化学试卷(解析版) 题型:实验题
硝酸铜是常用的一种无机化学试剂
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是__________
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO调节溶液的pH,根据下表数据,溶液的pH应保持在_________范围

③在滤液蒸发浓缩步骤中,适当加入稀硝酸的作用是__________________________
(2)某研究学习小组将一定质量的硝酸铜晶体【Cu(NO3)2•6H O】放在坩埚中加热,在不同温度阶段进行质量分析,绘制出剩余固体质量分数与温度关系如下图所示。据图回答下列问题:
O】放在坩埚中加热,在不同温度阶段进行质量分析,绘制出剩余固体质量分数与温度关系如下图所示。据图回答下列问题:
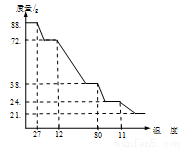
①当温度27℃<T<120℃时,反应的化学方程式为________②剩余固体质量为38.4g时,固体成分为【Cu(NO3)2•2Cu(OH)2】,当温度120℃<T<800℃时,反应的化学方程式为________ (此温度下,HNO 也分解)③当剩余固体质量为21.6g时,固体的化学式为_____________________
也分解)③当剩余固体质量为21.6g时,固体的化学式为_____________________
(3)制备无水硝酸铜的方法之一是用Cu与液态N O
O 反应,反应过程中有无色气体放出,遇到空气变红棕色。反应的化学方程式是_________________
反应,反应过程中有无色气体放出,遇到空气变红棕色。反应的化学方程式是_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com