
科目: 来源:2015-2016学年江苏省高二下期中化学试卷(解析版) 题型:选择题
四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g) 的速率测定实验,分别测得反应速率如下:
①v(A)= 0.15mol/(L·s)②v(B)= 0.6mol/(L·s) ③v(C)= 0.4mol/(L·s)④v(D)= 0.45mol/(L·s)。
其中反应进行得最快的是
A.① B.② C.③ D.④
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期中化学试卷(解析版) 题型:选择题
化学反应中一定伴随着能量的变化,下列有关能量的说法正确的是
A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
B.由C(石墨)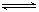 C(金刚石) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C(金刚石) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.根据热化学方程式:S(s) + O2(g)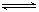 SO2(g) △H=—297.23kJ/mol,可推知1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和
SO2(g) △H=—297.23kJ/mol,可推知1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和
D.根据稀溶液中反应: H+(aq)+OH—-(aq)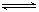 H2O(l) △H=—57.3kJ/mol;若将含0.5 mol H2SO4的浓硫酸与含l mol NaOH的稀溶液混合时,放出的热量大于57.3 kJ
H2O(l) △H=—57.3kJ/mol;若将含0.5 mol H2SO4的浓硫酸与含l mol NaOH的稀溶液混合时,放出的热量大于57.3 kJ
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期中化学试卷(解析版) 题型:选择题
在一密闭容器中充入NO2,在一定条件下进行反应:2NO2 2NO+O2。达到平衡状态的标志是
2NO+O2。达到平衡状态的标志是
A.NO2的消耗速率与NO的生成速率相等
B.容器内NO2的物质的量与NO的物质的量相等
C.NO2和O2的消耗速率之比为2∶1
D.单位时间内生成2n mol NO。同时生成n mol O2
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期中化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.化学平衡常数越大,说明该反应进行得越完全
B.可逆反应达到化学平衡状态后,改变外界条件不会改变平衡状态
C.化学反应中,物质含有的活化分子数目越多,化学反应速率越快
D.可逆反应维持的时间越长,生成物的百分含量必定越高
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期中化学试卷(解析版) 题型:选择题
可逆反应N2(g)+3H2(g) 2NH3(g),500 ℃时在容积为10 L的密闭容器中进行,开始时加入1 mol N2和6 mol H2,则达到平衡时,NH3的浓度不可能达到
2NH3(g),500 ℃时在容积为10 L的密闭容器中进行,开始时加入1 mol N2和6 mol H2,则达到平衡时,NH3的浓度不可能达到
A.0.1 mol·L-1 B.0.2 mol·L-1 C.0.05 mol·L-1 D.0.15 mol·L-1
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期中化学试卷(解析版) 题型:选择题
下列各组热化学方程式中,△H1>△H2的是
①C(s)+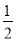 O2(g)=CO(g) △H1 C(s)+O2(g)=CO2(g) △H2
O2(g)=CO(g) △H1 C(s)+O2(g)=CO2(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+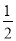 O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+CO2(g)=== CaCO3(s) △H2
A.①③④ B.②③④ C.①②③④ D.①②③
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期中化学试卷(解析版) 题型:选择题
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g)  N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)  2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g)  2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期中化学试卷(解析版) 题型:选择题
下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是
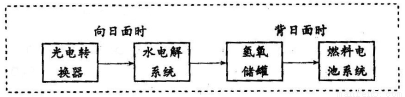
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑
D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期中化学试卷(解析版) 题型:选择题
在理论上可用于设计原电池的化学反应是
A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B.Ba(OH)2·8H2O(s)+2NH4C l(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H
l(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H  >0
>0
C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D.FeCl3(aq)十3H2O(1)  Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期中化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.决定化学反应速率的主要因素是反应物的浓度、压强、温度、催化剂等
B.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸的起始温度.NaOH溶液的起始温度和反应后反应体系的最高温度
C.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
D.某可逆反应的化学平衡常数K,只随温度的改变而改变,且温度越高K值一定越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com