
科目: 来源:2015-2016学年云南省高二下期中化学试卷(解析版) 题型:推断题
近来有新闻报道,在“酒鬼”酒中检验出“塑化剂”,“塑化剂”又名“增塑剂”,学名“邻苯二甲酸二正丁酯”,化学式:C16H22O4 , 其在工业上用途非常广泛,但其若进人人体则危害健康。“塑化剂”种类很多,其中一种“塑化剂”的制备流程如图:

已知: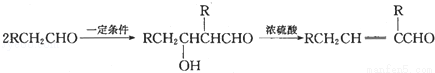
请回答下列问題:
(1)②是水解反应,其反应条件为: 。
(2)写出如图反应的反应类型:① ,⑤ ,⑦ 。
(3)写出下列方程式:③ ,⑥ ,⑧ 。
(4)写出D的属于酯类且含有两个甲基的同分异构体有 种,写出其中一种核磁共振氢谱有3个峰,且氢原子数为6:1:1的结构式 .
查看答案和解析>>
科目: 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关,下列说法正确的是( )
A.长期大量使用(NH4)2SO 化肥会使土壤酸化,而使用尿素[CO(NH2)2]则不会改变土壤酸碱性
B.硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果
C.普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料
D.氟氯烃是安全、环保的制冷剂
查看答案和解析>>
科目: 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,22.4 L乙烯中C—H键数为4NA
B.1 mol羟基中电子数为10NA
C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
D.常温下,1 L 0.1 mol·L-1 的NH4NO3溶液中氮原子数为0.2NA
查看答案和解析>>
科目: 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:选择题
下列实验方法或装置正确的是( )
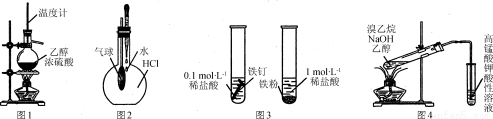
A.用图1所示装置制取乙烯
B.用图2所示方法验证HCl气体易溶于水
C.用图3所示方法探究固体表面积对反应速率的影响
D.用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯
查看答案和解析>>
科目: 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:选择题
下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
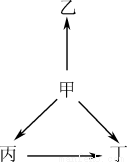
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Na | Na2O | NaOH | Na2O2 |
C | SiO2 | SiF4 | H2SiO3 | Na2SiO3 |
D | Al | AlCl3 | Al2O3 | NaAlO2 |
查看答案和解析>>
科目: 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:选择题
Cyrneine A对治疗神经系统疾病有着很好的疗效。可用香芹酮经过多步反应合成:
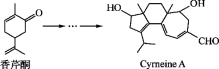
下列说法不正确的是( )
A. 香芹酮的分子式为C10H14O
B. Cyrneine A可以发生加成反应、消去反应和氧化反应
C. 香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色
D. 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有3种
查看答案和解析>>
科目: 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:选择题
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A.物质A由Z与Y两种元素组成,则0.5mol物质A中含有的离子数约为9.03×1023
B.元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大
C.元素Z、R的氧化物的水化物之间相互反应生成的盐溶液呈中性或碱性
D.元素Y、R分别与元素X形成的化合物的沸点:XmY<XmR
查看答案和解析>>
科目: 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:选择题
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )

A. W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. pH=4的溶液中:c(H2CO3)+c(HCO32-)+c(CO32-)<0.1 mol·L-1
C. pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D. pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO32- )>c(H2CO3)
查看答案和解析>>
科目: 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:实验题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
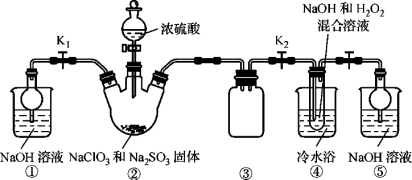
(1)装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 ;装置④中制备NaClO2的化学方程式为 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55 ℃蒸发结晶;②趁热过滤;③ ;④低于60 ℃干燥,得到成品。
实验Ⅱ. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为 。
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
科目: 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:填空题
工业上利用电镀污泥 (主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
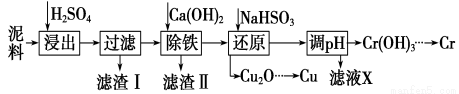
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
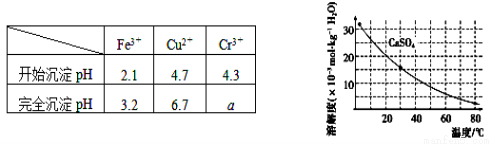
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有__________________。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约________,检验Fe3+已经除尽的操作是_________________;
②将浊液加热到80℃,______________________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式: ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是_______。
(4)当离子浓度小于或等于1×10-5mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持 c(OH-)≥______。[已知:Ksp[Cr(OH)3]=6.3×10-31,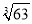 ≈4.0]。
≈4.0]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com