
科目: 来源:2016届安徽省高三下学期适应性考试理综化学试卷(解析版) 题型:选择题
在2L的密闭容器中发生反应xA(g)+yB(g) zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
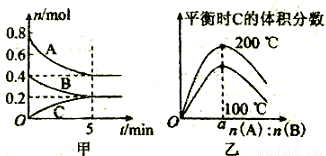
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
查看答案和解析>>
科目: 来源:2016届安徽省高三下学期适应性考试理综化学试卷(解析版) 题型:选择题
将甲烷设计成燃料电池,其利用率更高,如图所示(A, B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL,则下列说法错误的是()

A.通入CH4的一端为原电池的负极,溶液中OH-向负极区移动
B.当0<V ≤22.4L时,电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O
C.当22.4L<V≤44.8L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-
D.当V=33.6L时,溶液中阴离子浓度大小关系为c(CO32-)>c(HCO3-)>c(OH-)
查看答案和解析>>
科目: 来源:2016届安徽省高三下学期适应性考试理综化学试卷(解析版) 题型:选择题
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )

A.该有机物的分子式为C7H7O3
B.该有机物能发生取代、加成和氧化反应
C.1mol该有机物最多能与2mol H2发生加成反应
D.该有机物的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目: 来源:2016届安徽省高三下学期适应性考试理综化学试卷(解析版) 题型:选择题
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:四种元素的电子层数之和为10,且它们分别属于连续的四个主族;四种元素的原子中半径最大的是X原子.下列说法正确的( )
A.四种元素中有两种元素在第二周期
B.W所在主族元素的原子次外层电子数可能为2或8,不可能为18
C.X、Y、Z的最高价氧化物对应的水化物两两之间能反应
D.工业上获得X、Y单质的方法主要是电解其熔融的氯化物
查看答案和解析>>
科目: 来源:2016届安徽省高三下学期适应性考试理综化学试卷(解析版) 题型:选择题
下列实验能达到预期目的是( )
编号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸分别测定浓度为0.1mol•L-1 NaClO溶液和0.1mol•L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
查看答案和解析>>
科目: 来源:2016届安徽省高三下学期适应性考试理综化学试卷(解析版) 题型:选择题
常温时,向一定量的硫酸铜溶液中滴加pH=11的氨水,当Cu2+完全沉淀时,消耗氨水的体积为V,下列说法正确的(Ksp[Cu(OH)2]=2.2×10-20)( )
A.滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO4 2-)
B.滴加过程中,当溶液中c(Cu2+)=2.2×10-2mol/L时,溶液的pH=9
C.若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V
D.若将氨水加水稀释,则稀释过程中, 始终保持增大
始终保持增大
查看答案和解析>>
科目: 来源:2016届安徽省高三下学期适应性考试理综化学试卷(解析版) 题型:实验题
某矿样含有大量的CuS及少量其它不溶于酸的杂质.实验室中以该矿样为原料制备CuCl2•2H2O晶体,流程如下:

(1)在实验室中,欲用37%(密度为1.19g•mL-1)的盐酸配制500mL 6mol•L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒、500mL容量瓶外,还有_____________;
(2)①若在实验室中完成系列操作a.则下列如图2实验操作中,不需要的是_____________(填下列各项中序号).

②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是_____________(填序号).
CuCl42-(黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是_____________(填序号).
a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如图所示。
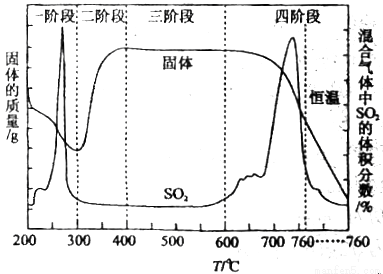
①CuS矿样在焙烧过程中,有Cu2S、CuO•CuSO4、CuSO4、CuO生成,转化顺序为:
第①步转化主要在200~300℃范围内进行,该步转化的化学方程式为_____________,
②300~400℃范围内,固体质量明显增加的原因是_____________,上图所示过程中,CuSO4固体能稳定存在的阶段是_____________(填下列各项中序号).
a.一阶段 b、二阶段 c、三阶段 d、四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。

a.装置组装完成后,应立即进行气密性检查,请写出检查A-D装置气密性的操作:_____________。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物.你认为装置D中原来盛有的溶液为_____________溶液,
查看答案和解析>>
科目: 来源:2016届安徽省高三下学期适应性考试理综化学试卷(解析版) 题型:简答题
工业制硫酸的过程中利用反应2SO2(g)+O2(g)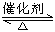 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收.请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收.请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,则下列说法正确的是_____________
A.若反应速率v(SO2)﹦v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2mol SO3,再次平衡时SO2的百分含量比原平衡时SO2的百分含量小
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | 4 | 2 | 0.4 | y | 9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为_____________;
②T1_____________T2,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为_____________;
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3.现有常温下0.1mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:
①用离子方程式表示该溶液呈碱性的原因:_____________;
②该溶液中c(OH-)=c(Na+)+_____________(用溶液中所含微粒的浓度表示).
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是_____________
A.Na2CO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4
查看答案和解析>>
科目: 来源:2016届安徽省高三下学期适应性考试理综化学试卷(解析版) 题型:实验题
某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁.其生产工艺流程如下:
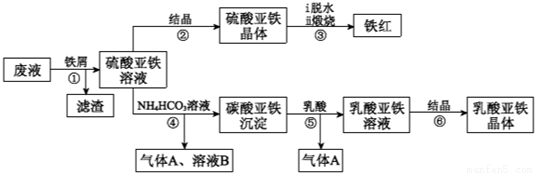
已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2•xH2O↓+H2SO4.
请回答:
(1)步骤①所得滤渣的主要成分为_____________,
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_____________,
(3)步骤④需控制反应温度低于35℃,其目的是_____________,
(4)步骤④的离子方程式是_____________,
(5)已知:FeCO3(S) Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________,
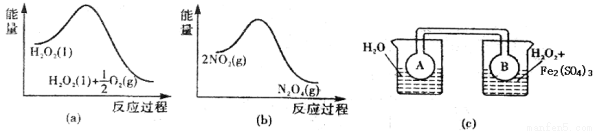
(7)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深,其原因是_____________。
查看答案和解析>>
科目: 来源:2016届安徽省高三下学期适应性考试理综化学试卷(解析版) 题型:实验题
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
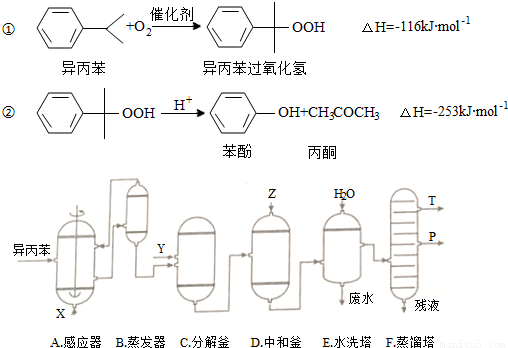
相关化合物的物理常数
物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
异丙苯 | 120 | 0.8640 | 153 |
丙酮 | 58 | 0.7898 | 56.5 |
苯酚 | 94 | 1.0722 | 182 |
回答下列问题:
(1)在反应器A中通入的X是_____________;
(2)反应①和②分别在装置_____________和_____________中进行(填装置符号).
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是_____________;
(4)中和釜D中加入的Z最适宜的是_____________(填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(5)蒸馏塔F中的馏出物T和P分别为_____________和_____________,判断的依据是_____________;
(6)用该方法合成苯酚和丙酮的优点是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com