
科目: 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:选择题
下列关于有机物的说法中,不正确的是
A.用水能够鉴别苯和溴苯
B.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
C.除去乙醇中少量的乙酸:加入足量生石灰,蒸馏
D.氯乙烯分子内所有原子均在同一平面
查看答案和解析>>
科目: 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:选择题
两种气态烃组成的混合气体,完全燃烧后得到CO2 和H2O的物质的量随着混合烃物质的量的变化,如图所示,则下列对混合烃的判断正确的是
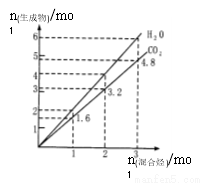
①可能有C2H4 ②一定有CH4 ③一定有C3H8
④一定没有C2H6 ⑤可能有C2H6 ⑥可能有C2H2
A.②⑤⑥ B.①②④ C.④⑥ D.②③
查看答案和解析>>
科目: 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:选择题
下图表示某高分子化合物的结构片断,关于该高分子化合物的推断正确的是
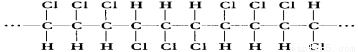
A.该高分子是经由缩聚反应得到
B.该高分子的分子式是(C3H3Cl3)n
C.聚合物的单体是CHCl=CHClCH3
D.若n为聚合度,则其相对分子质量为97n
查看答案和解析>>
科目: 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常熟的值,下列说法正确的是( )
A.14 g乙烯和丙烯的混合物中总原子数为2NA个
B.在1mol的CH5+中所含的电子数为10NA
C.16g CH4与18 g NH4+ 所含质子数相等
D.11.2 L的甲烷气体含有甲烷分子数一定为0.5NA个
查看答案和解析>>
科目: 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:实验题
实验室制取溴乙烷的主反应如下:

副反应:在该实验中经常会有乙醚、溴等副产物生成,装置如图所示。

相对分子质量 | 密度/(g·cm—3) | 沸点/℃ | 溶解度 | |
乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
实验步骤:
①向A中先加入5 mL 95%的无水乙醇(0.085 mol)和4.5 mL的水,加入溴化钠7.725 g ,再加入沸石,摇匀。在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中。
②在B中加入9.5 mL浓硫酸(0.17 mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2 mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加入沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g。
回答问题:
(1)仪器E的名称为 ;反应装置中有使用C、D两根温度计,其中D温度计的作用是: 。
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是 。饱和亚硫酸氢钠溶液的作用是 ;
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有 (填标号)。
A.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 D.减少因浓硫酸氧化HBr而生成副产物溴;
(4)步骤③中分出馏出液中有机层的操作名称为 。加入浓硫酸除杂后的溶液明显分层,粗产物在 层(填“上”或“下”);
(5)本实验的产率为 。
查看答案和解析>>
科目: 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:实验题
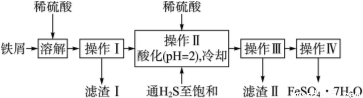
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
查询资料,得有关物质的相关数据如表:
25 ℃时 | pH[] |
饱和H2S溶液 | 3.9 |
SnS沉淀完全 | 1.6 |
FeS开始沉淀 | 3.0 |
FeS沉淀完全 | 5.5 |
(1)操作Ⅱ中,通入硫化氢至饱和的目的是_______;在溶液中用硫酸酸化至pH=2的目的是________。
(2)滤渣Ⅱ的主要成分是__________。
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②_____________________________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850 g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形 瓶中;c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.
瓶中;c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20. 00 mL。
00 mL。
①滴定时盛放KMnO4溶液的仪器为__________(填仪器名称)。
②判断此滴定实验达到终点的方法是____________________________。
③计算上述样品中FeSO4·7H2O的质量分数为____________________。
查看答案和解析>>
科目: 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:填空题
苯的同系物是人类最早认识的芳香族化合物,其中对二甲苯(英文名称p—xylene,缩写为PX)是化学工业的重要原料。
已知:
(1)写出PX的结构简式______________。
(2)PX可能发生的反应有__________、_____________。(填反应类型,只填两种。)
(3)有机物M存在如下图所示的转化关系,其中A 是PX的一种同分异构体。

已知:M的分子式为C16H22O4,D能发生银镜反应。
①B的苯环上存在3 种不同化学环境的氢原子,则B 的结构简式是__________。
②D分子中所含的官能团是______________(填化学式)。
③M的结构简式是_______________。
(4)F是B的一种同分异构体,具有如下特征:
a.是苯的对位二取代物; b.遇FeCl3溶液显示紫色; c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式_____________________________。
查看答案和解析>>
科目: 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:填空题
塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料。添加塑化剂(简称DBP,分子式为C16H18O4)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害。其合成线路图如图I所示:
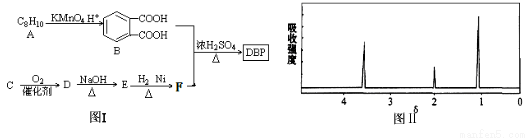
已知以下信息:
①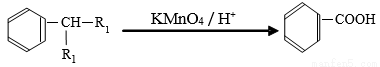
② 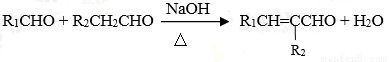 (—R1、R2表示氢原子或烃基)
(—R1、R2表示氢原子或烃基)
③C的摩尔质量为46,是含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图II所示
请根据以上信息回答下列问题:
(1)C的结构简式为 ,E中所含官能团的名称是 。
(2)写出下列有关反应的化学方程式:
①当E和H2以物质的量比1︰1反应生成F: ;
②B和F以物质的量比1︰2合成DBP: ,该反应的反应类型为 。
(3)同时符合下列条件的B的同分异构体有 种,写出其中任意两种同分异构体的结构简式 。
①不能和NaHCO3溶液反应 ②能发生银镜反应
③遇FeCl3溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
查看答案和解析>>
科目: 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:填空题
硼及其化合物在工业上有许多用途。工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4。
(1)基态铁原子的外围电子层排布为_____________,该元素位于元素周期表中的第_____________族,在水溶液中常以Fe2+、Fe3+的形式存在,其中_____________更稳定。
(2)以硼酸 为原料可制得NaBH4,B原子的杂化方式为_____________。
为原料可制得NaBH4,B原子的杂化方式为_____________。
(3)第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
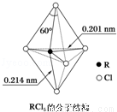
A.分子中5个R﹣Cl键键能不都相同
B.键角(Cl﹣R﹣Cl)有90°、120、180°几种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.每个原子都达到8电子稳定结构
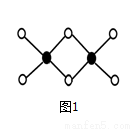
(4)因为氯化铝易升华,其双聚物Al2Cl 6结
6结 构如图1所示。1mol该分子中含__________个配位键,该分子________(填“是”或“否”)平面型分子。
构如图1所示。1mol该分子中含__________个配位键,该分子________(填“是”或“否”)平面型分子。
(5)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8 K,主要原因是_________。
(6)二硫化碳属于_________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目: 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种元素。其相关信息如下:
元素 | 相关信息 |
A | A元素的一种原子没有中子,只有一个质子 |
B | B是电负性最大的元素 |
C | C的基态原子2p轨道有三个未成对电子 |
D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
E | E能形成砖红色(红色)的E2O和EO两种氧化物 |
回答下列问题。
(1)写出E元素原子基态时M层的电子排布式 。
(2)C元素单质分子中含有δ和π键的键数之比为 。
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是: 。
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有 (填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为 (填序号)。
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)三硫化四磷是黄绿色针状结晶,其结构如图所示。

三硫化四磷分子中P原子采取____杂化,与PO3-互为等电子体的化合物分子的化学式为________。用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com