
科目: 来源:2015-2016学年广西南宁市高二下学期期中化学试卷(解析版) 题型:选择题
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9 mol2·L-2,下列说法不正确的是

A.x数值为2×10-5
B.c点时有碳酸钙沉淀生成
C.加入蒸馏水可使溶液由d点变到a点
D.b点与d点对应的溶度积相等
*
查看答案和解析>>
科目: 来源:2015-2016学年广西南宁市高二下学期期中化学试卷(解析版) 题型:实验题
某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用0.14mol·L-1NaOH标准溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写)____________;
②该滴定操作中应选用的指示剂是__________;
③在G操作中确定终点的方法是__________________________。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏低”、“偏高”或“无影响”)__________________。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是_____
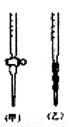
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(选填“甲”或“乙”)中。
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值____________(选填“偏高”“偏低”或“无影响”)
(6)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)____________。
查看答案和解析>>
科目: 来源:2015-2016学年广西南宁市高二下学期期中化学试卷(解析版) 题型:填空题
在常温下,下列五种溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4③ 0.1mol/L NH4HSO4 ④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液⑤0.1mol/L NH3·H2O请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是 (用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 ﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是② ③ ﹝填“>”、“<”或“=”)
(4)在溶液④中, 离子的浓度为0.1mol/L;NH3·H2O和 离子的物质的量浓度之和为0.2 mol/L
(5)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”) NH4+ 的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源:2015-2016学年广西南宁市高二下学期期中化学试卷(解析版) 题型:填空题
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)  Si3N4(s)+ 6CO(g)
Si3N4(s)+ 6CO(g)
(1)该反应的氧化剂是 ,其还原产物是 ;
(2)该反应的平衡常数表达式为K= ;
(3)若知上述反应为放热反应,则其反应热△H 0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)= .
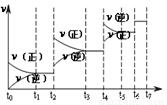
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率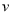 与时间t的关系如右图。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。
与时间t的关系如右图。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。
(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是 (提示:272 = 729)
查看答案和解析>>
科目: 来源:2015-2016学年广西南宁市高二下学期期中化学试卷(解析版) 题型:填空题
利用如图所示装置电解硝酸银溶液和饱和硫酸钠溶液(甲中盛有AgNO3溶液,乙中盛有饱和Na2SO4溶液)。

(1)通电一段时间,观察到湿润的淀粉KI试纸的____(选填“C”或“D”)端变蓝。
(2)装置甲中阳极为________,阴极的电极反应式为_______________________。
(3)装置乙中观察到的现象是________________________________________。
(4)电解一段时间后,装置甲、乙中共收集到气体0.168 L(标准状况下),而且该时间段内装置乙中析出硫酸钠晶体(Na2SO4·10H2O)w g,测得装置甲中溶液的体积为1 L,则装置甲中溶液的pH为________。电解前饱和Na2SO4溶液中溶质的质量分数的计算式为________________(计算时忽略电解过程中的其他副反应)。
查看答案和解析>>
科目: 来源:2015-2016学年河北省邯郸市高一5月月考化学试卷(解析版) 题型:选择题
下列化学用语表述正确的是( )
A.HC1的电子式: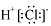 B.NaCl的电子式:
B.NaCl的电子式: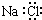
C.S2-的原子结构示意图: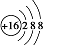 D.H2O2的电子式:
D.H2O2的电子式: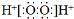
查看答案和解析>>
科目: 来源:2015-2016学年河北省邯郸市高一5月月考化学试卷(解析版) 题型:选择题
下列物质属于离子化合物且含有共价键的是
A.KOH B.MgCl2 C.HCl D.N2
查看答案和解析>>
科目: 来源:2015-2016学年河北省邯郸市高一5月月考化学试卷(解析版) 题型:选择题
下列叙述中,能证明Li金属比Mg金属活泼性强的是( )
A.Li原子的最外层电子数比Mg原子的最外层电子数少
B.Mg原子的电子层数比Li原子电子层数多
C.1 mol Mg从酸中置换出的H2比1 mol Li从酸中置换出的H2多
D.氢氧化锂的碱性比氢氧化镁强
查看答案和解析>>
科目: 来源:2015-2016学年河北省邯郸市高一5月月考化学试卷(解析版) 题型:选择题
下列叙述中,正确的是( )
A.石油、煤、氢气都属于化石燃料 B.化合反应都是放热反应
C.分解反应都是吸热反应 D.风能可以转化为电能
查看答案和解析>>
科目: 来源:2015-2016学年河北省邯郸市高一5月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.化学反应的实质是旧化学键断裂和新化学键的形成
B.物质由高能量向低能量转化时,放出热量
C.将一定质量的C燃烧,生成CO2时比生成CO时放出的热量多
D.干冰升华时放出大量的热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com