
科目: 来源:2015-2016学年浙江余姚中学高一普通班下期中化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应如下,在负极发生反应的物质是
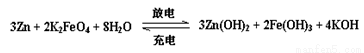
A.Zn B.K2FeO4 C.Zn(OH)2 D.Fe(OH)3
查看答案和解析>>
科目: 来源:2015-2016学年浙江余姚中学高一普通班下期中化学试卷(解析版) 题型:选择题
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下。下列说法不正确的是
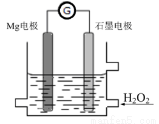
A.石墨电极是该电池的正极
B.石墨电极上发生还原反应
C.Mg电极的电极反应式:Mg-2e-=Mg2+
D.电池工作时,电子从Mg电极经导线流向石墨电极,再出石墨电极经电解质溶液流向Mg电极
查看答案和解析>>
科目: 来源:2015-2016学年浙江余姚中学高一普通班下期中化学试卷(解析版) 题型:选择题
将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的平均摩尔质量不变
D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目: 来源:2015-2016学年浙江余姚中学高一普通班下期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.MgF2晶体中的化学键是共价键
B.某物质在熔融态能导电,则该物质中一定含有离子键
C.N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D.干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力
查看答案和解析>>
科目: 来源:2015-2016学年浙江余姚中学高一普通班下期中化学试卷(解析版) 题型:实验题
某研究性小组决定用实验探究的方法证明化学反应具有一定的限度。取5mL0.1mol/LKI溶液于试管中,滴加0.1mol/LFeCl3溶液2mL,发生如下反应:2Fe3++2I-=2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全; ②再取少量反应液,加入少量CCl4振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成.综合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度.
(1)老师指出他们上述实验中①不合理,你认为是___________ ;改进的方法是______________。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是______________________________。
查看答案和解析>>
科目: 来源:2015-2016学年浙江余姚中学高一普通班下期中化学试卷(解析版) 题型:推断题
观察下面的元素周期表,并回答下列问题
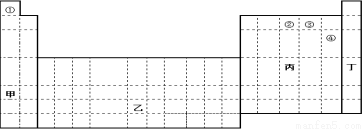
(1)在上面元素周期表中,全部是金属元素的区域为
甲 乙 丙 丁
(2)用实线画出金属与非金属的分界线。(在答题卷图上完成)
(3)请问:仅用①②④三种元素 (填“能”或“不能”)形成离子化合物;若能,请写出该物质的名称_________(若不能,此格不填)若用球棍模型表示①和③形成的化合物的分子结构,应该是 。

查看答案和解析>>
科目: 来源:2015-2016学年浙江余姚中学高一普通班下期中化学试卷(解析版) 题型:填空题
目前,市场上有多种“热敷袋”出售,有一次性的,有可以重复使用的。某一化学研究性学习小组在研究了某种“热敷袋”的构造后,决定自己制造一个一次性“热敷袋”,制造过程如下:①称取15g小颗粒状活性炭,40g还原铁粉,5g细木屑,都放在一只烧杯中,再加入15mL 15%食盐水,用玻璃棒搅拌均匀。②用大头针在小塑料袋上扎几十个针眼 (袋的两层同时扎穿),把烧杯里的混合物全部加入小塑料袋中,封上袋口,再放入大塑料袋中,封上袋口,可长期保存。③使用时将大塑料袋袋口打开,反复搓揉这袋5min~8min,能感觉温度明显上升。回答下列问题:
(1)该一次性“热敷袋”利用了 原理。
(2)使用时将大塑料袋袋口打开的原因是让氧气进入反应,写出其电极反应式 ;炭粉的作用是 。
(3)将使用过的“热敷袋”打开,发现有大量棕红色粉末生成,该物质主要成分是 ,
写出生成该物质的化学反应方程式:① ;② 。
查看答案和解析>>
科目: 来源:2015-2016学年浙江余姚中学高一普通班下期中化学试卷(解析版) 题型:实验题
某学习小组探究金属与不同酸反应的差异,以及影响反应速率的因素。
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2 .0mol/L硫酸、4.0mol/L硫酸,相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g。
(1)帮助该组同学完成以上实验设计表。
实验目的 | 实验 编号 | 温度 | 金属铝 形态 | 酸及浓度 |
1.实验①和②探究盐酸浓度对该反应速率的影响 2.实验②和③探究 3.实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响; 4.①和⑤实验探究铝与稀盐酸和稀硫酸反应的差异 | ① | 铝片 |
| |
② | 25?C | 铝片 | 2.0mol/L盐酸 | |
③ | 35?C | 铝片 | 2.0mol/L盐酸 | |
④ |
| 铝粉 |
| |
⑤ | 25?C | 铝片 | 2.0mol/L硫酸 |
(2)该小组同学在对比①和⑤实验时发现①的反应速度都明显比⑤快,你能对问题原因作出哪些假设或猜想(列出一种即可)?
查看答案和解析>>
科目: 来源:2015-2016学年浙江余姚中学高一普通班下期中化学试卷(解析版) 题型:实验题
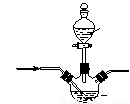
【加试题】硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下:

(1)写出反应Ⅰ的离子方程式: (任写一个)。
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是 ,可采取的措施为 。
(3)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是 。
(4)若用右图所示实验装置制取Al(NO3)3,通入水蒸气的作用是 。
查看答案和解析>>
科目: 来源:2015-2016学年浙江余姚中学高一普通班下期中化学试卷(解析版) 题型:填空题
【加试题】Ⅰ煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO (g)+H2O (g)?H2 (g)+CO2 (g)平衡常数K随温度的变化如下表
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2 (g)?2CO (g)平衡常数K1
C(s)+H2O (g)?H2 (g)+CO (g)平衡常数K2,
则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆 (填“>”、“=”或“<”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com