
科目: 来源:2015-2016学年重庆市高一下期中化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成NA个H2分子
B.23gNO2和N2O4混合气体中含有原子总数为1.5NA
C.足量Cu和100mL18mol/L热浓硫酸反应可生成0.9 NA个SO2分子
D.3mol单质Fe完全转变为Fe3O4,失去9 NA个电子
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高一下期中化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红色的溶液中:Na+、AlO2-、SO42-、Cl-
B.使紫色石蕊试纸变红的溶液中:K+、Fe2+、NO32-、Ca2-
C.与Al反应能放出H2的溶液中:Na+、K+、NO3-、HCO3-
D.显强酸性的溶液中: Na+、SO42-、ClO-、Cl-
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高一下期中化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.过氧化钠反应生成NaOH和O2:Na2O2+H2O=2Na++2OH-+O2↑
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高一下期中化学试卷(解析版) 题型:选择题
“类推”这种思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是
①钠与水反应生成NaOH和H2,所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈,性质更活泼的铝不能稳定存在于空气中
③Cu(OH)2受热易分解,Fe(OH)3受热也易分解
④Al(OH)2能与NaOH反应,Be(OH)2也能与NaOH反应
A.①③ B.②④ C.①② D.①②④
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高一下期中化学试卷(解析版) 题型:选择题
将64g铜与一定浓度的浓硝酸反应,铜完全溶解产生的NO和NO2混合气体在标况下的体积为33.6L,欲使反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要40%的双氧水的质量为
A.85g B.79g C.116g D.58g
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高一下期中化学试卷(解析版) 题型:选择题
一定量的氢气在氯气中燃烧,所得混合物冷却后用500mL 0.6mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,参加反应的氢气和所用氯气的物质的量之比为
A.3:1 B.3:2 C.2:3 D.3:4
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高一下期中化学试卷(解析版) 题型:推断题
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素,Y的单质在W2中燃烧的产物可使品红溶液褪色.Z和W元素形成的化合物Z3W4具有磁性.U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)X在周期表中的位置为______;UW2的电子式为______;X在UW2中剧烈燃烧生成的黑、白两种固体中化学键类型依次是______、______。
(2)U、V、W形成的10电子氢化物中,最稳定的是______(写化学式、下同);沸点最高的是______;结合H+能力最强的是(写化学式)______。
(3)Z3W4与稀盐酸反应的离子方程式为______。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为______,由此可知VW和YW2还原性较强的是(写化学式)______。
(5)已知YW2和Cl2均可使品红溶液褪色,现将一定量的YW2和Cl2通入品红溶液中:
①若品红不褪色,则品红溶液中所发生的化学方程式为______。
②若品红褪色,为证明YW2和Cl2谁过量,最简单的操作、现象、结论是______。
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高一下期中化学试卷(解析版) 题型:实验题
i.利用下图装置可验证同主族元素非金属性的变化规律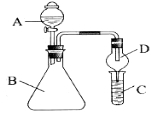
(1)仪器A的名称为______,干燥管D的作用是______。
(2)若要证明非金属性:C1>I,则A中加浓盐酸,B中加______(填名称),C中加淀粉-碘化钾溶液,观察到C中溶液______的现象,即可证明。从环境保护的观点 ,此装置的不足之处是_________。
(3)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3,C中加_________(填试剂)即可证明。乙同学认为此方案有不足之处,应在B、D两装置间加装有_________(填试剂)的洗气瓶。
ii.金属Na、Mg、Al有广泛的应用
(4)金属Na、Mg、Al的金属性,进行了如下实验:
实验1:各取1.0g金属钠和镁,分别加入到5mL水中,钠与谁反应剧烈,镁与水反应缓慢。
实验2:各取1.0g的镁条和铝条,分别加入到5mL1.0mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈。
实验1和实验2得出的结论是_________,用原子结构理论解释;同周期元素从左到右,_________。
(5)Na、Mg、Al都可用于制备储氢的金属氢化物。
① NaH是离子化合物,其电子式为_________。能与水发生氧化还原反应生成H2,该反应的还原剂是_________ 。NaH在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学式为_________。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应的化学方程式是_________。
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高一下期中化学试卷(解析版) 题型:实验题
工业上,向500-600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。
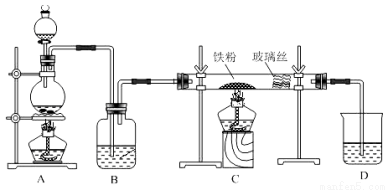
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 ,当生成1molCl2时,转移的电子数为 ,玻璃丝的作用是 ,装置B中加入的试剂是 。装置D中加入的试剂是 。
(2)制取无水氯化亚铁的实验中,尾气的成分是 。若仍用D的装置进行尾气处理,存在的问题是 、 。
(3)若操作不当,制得的FeCl2会含有少量FeCl3杂质,下列说法中正确的是
A.检验FeCl3常用的试剂是KSCN溶液
B.可向固体混合物中加入适量Fe粉除去杂质
C.可向固体混合物中通入适量Cl2除去杂质
D.欲制得纯净的FeCl2,在实验操作中应先点燃A处的酒精灯,在点燃C处的酒精灯。
(4)现有一包FeCl2和FeCl3混合物,某化学兴趣小组为测定各成分的含量进行如下两个实验:
实验1:①称取一定质量的样品,将样品溶解;②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;③将沉淀过滤、洗涤、干燥得到白色固体28.7g。
实验2:①称取与实验1中相同质量的样品,溶解;②加入足量的NaOH溶液,③将沉淀过滤、洗涤后,加热灼烧到质量不再减少,得到固体6.4g。则样品中FeCl3的物质的量为 。
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高一下期中化学试卷(解析版) 题型:填空题
附加题
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题。
(1)H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为 元酸。
(2)H3PO2是中强酸,写出其与NaHCO3溶液反应的离子方程式 。
(3)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为__________;
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为_______(填化学式);
(4)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com