
科目: 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:选择题
钠镍氯化物电池是一种新型可充电电池,其工作原理如图,图中固体电解质为Na+导体,下列叙述正确的是( )

A.放电时,电极a发生还原反应
B.放电时,电解质中Na+由电极a移向电极b
C.电池充电时的总反应为2Na+NiCl2=2NaCl+Ni
D.可将装置中的固体电解质改为NaCl溶液
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:选择题
一定质量的乙烯完全燃烧放出的热量为a KJ,将产生的CO2通入50ml 8mol/L NaOH溶液中,恰好完全吸收,则1mol乙烯完全燃烧放出的热量Q为( )
A.Q<5a KJ B.Q>10a kJ
C.5a kJ≤Q≤10a kJ D.无法确定
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:选择题
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L HCl溶液和20.00mL 0.1000mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示,下列说法正确的是( )

A.图2是滴定盐酸的曲线
B.a与b的关系是:a<b
C.E点对应离子浓度由大到小的顺序是:C(CH3COO-)>C(Na+)>c(H+)>C(OH-)
D.这两次滴定都可以用甲基橙作指示剂
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:选择题
已知某密闭容器中发生反应X(g)+Y(g) 2W(s)+Z(g)△H<0(Y物质极易被液化),有关说法正确的是( )
2W(s)+Z(g)△H<0(Y物质极易被液化),有关说法正确的是( )
A.其他条件不变,只改变压强,该反应平衡常数一定不变
B.平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小
C.若Z为有颜色的物质,达到平衡后,增大压强,体系颜色变浅
D.平衡时,其他条件不变,分离Z,正反应速率加快
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:选择题
将适量AgBr固体溶在水中,溶液中存在AgBr(s) Ag+(aq)+Br-(aq)。则下列说法正确的是( )
Ag+(aq)+Br-(aq)。则下列说法正确的是( )
A.向此体系中滴加足量浓NaCl溶液,发现沉淀转化为白色,说明Ksp(AgCl)<Ksp(AgBr)
B.某溶液中c(Ag+)·c(Br-)=Ksp(AgBr),说明此时c(Ag+)=c(Br-)
C.向此体系中加入少量AgBr固体,平衡正向移动,当再次平衡时c(Ag+)、c(Br-)增大
D.此体系中一定存在c(Ag+)=c(Br-)=[Ksp(AgBr)]1/2
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是( )
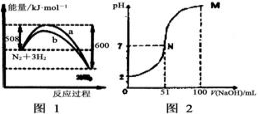
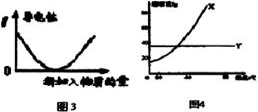
A.图1表示反应过程中,a曲线对应的温度高于b曲线对应的温度
B.图2表示常温下,向100ml0.1mol/LH2R(二元酸)溶液中逐滴加入0.2mol/L NaOH溶液,混合溶液的pH变化情况(体积变化忽略),M点对应的溶液中离子浓度由大到小的顺序为c(Na+)>c(R2-)>c(OH-)>c(H+)
C.图3表示向乙酸溶液中通入NH3过程中溶液导电性的变化
D.图4表明可用蒸馏法分离X和Y
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:选择题
在密闭容器中,将2.0mol CO和10mol H2O混合加热到800℃,达到下列平衡:CO(g)+H2O(g) CO2(g)+H2(g) K=1.0。则有关该平衡的说法正确的是( )
CO2(g)+H2(g) K=1.0。则有关该平衡的说法正确的是( )
A.CO转化为CO2的转化率为83%
B.平衡时,H2O(g)的浓度为8.34mol/L
C.已知该反应在427℃时的平衡常数为9.4,则该反应为吸热反应
D.改变该平衡体系的温度、压强或各组分的浓度,该平衡一定能发生移动
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:简答题
甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
(1)已知:CO(g)+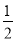 O(g)=CO2(g) △H1=-283.0kJ·mol-1
O(g)=CO2(g) △H1=-283.0kJ·mol-1
H2(g)+ 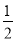 O2(g)=H2O(l) △H2=-285.8kJ·mol-1
O2(g)=H2O(l) △H2=-285.8kJ·mol-1
CH3OH(g)+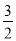 O2(g)=CO2(g)+2H2O(l) △H3=-764.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H3=-764.5kJ·mol-1
则CO(g)+2H2(g)=CH3OH(g) △H=__________kJ·mol-1
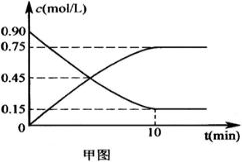
(2)甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)=____________________。
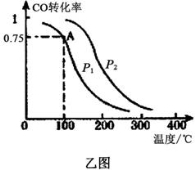
(3)一定条件下,在容积为VL的密闭容器中充入amolCO与2amolH2合成甲醇,平衡转化率与温度、压强的关系如乙图所示。
①P1__________P2(填“>”、“<”或“=”)
②该甲醇合成反应在A点的平衡常数K=__________(用a和V表示)
③下列措施中能够同时满足增大反应速率和提高CO转化率的是__________。(填写相应字母)
A.使用高效催化剂B.降低反应温度
C.增大体系压强D.不断将CH3OH从反应混合物中分离出来
E.向体系中再充入amolCO与2amolH2
查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:简答题
如下图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深。请回答:
(1)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__________。
(2)现用丙装置给铜件镀银,当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为__________。
(3)Fe(OH)3胶体的制备有严格的要求,小明想向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体,结果很快就生成了红褐色的沉淀。他测得溶液的pH=5,则此时溶液中c(Fe3+)=__________mol/L。(己知Ksp[Fe(OH)3]=1×10-36)。
(4)若用甲烷燃料电池(电解质溶液为2L2mol/LKOH溶液)提供电源,持续通入甲烷,在标准状况下,消耗甲烷的体积VL。当消耗CH4的体积在44.8<V≤89.6时,此时电源中B极发生的电极反应为:__________。

查看答案和解析>>
科目: 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:实验题
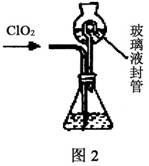
近年来各国都在寻找对环境无害而作用快速的消毒剂,其中二氧化氯(ClO2)是目前国际上倍受瞩目的第四代高效、无毒的消毒剂。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某兴趣小组的学生设计了如下模拟装置来制取、收集ClO2并测定其质量。
查阅资料:ClO2是一种黄红色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,温度过高可能引起爆炸,易溶于水,易与碱液反应。
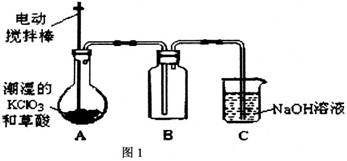
实验Ⅰ:制取并收集ClO2,如图1装置所示。
(1)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式__________。
(2)装置A必须添加温度控制装置,其温度要保持在60~80℃之间,控制温度的目的是__________。装置B也必须添加温度控制装置,应该是__________(填“冰水浴”或“沸水浴”或“60℃的热水浴”)装置。
实验Ⅱ:测定ClO2质量,如图2装置所示。过程如下:
在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;按照图2组装好仪器;在玻璃液封管中加入水,浸没导管口;将生成的ClO2气体由导管通入锥形瓶的溶液中充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液:用cmol/L硫代硫酸钠标准液滴定锥形瓶中的液体,共用去VmL硫代硫酸钠溶液(己知:I2+2S2O32-=2I-+S4O62-)。
(3)装置中玻璃液封管的作用是____________________。
(4)滴定终点的现象是____________________。
(5)测得通入ClO2的质量m(ClO2)=__________g(用整理过的含c、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com