
科目: 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:选择题
化学在工农业生产和日常生活中都有重要应用。下列叙述正确的是( )
A.葡萄糖和蛋白质等高分子化合物是人体必需的营养物质
B.将草木灰和硫酸铵混合施用,肥效更高
C.用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应
D.棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品
查看答案和解析>>
科目: 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:选择题
右图为元素周期表短周期的一部分。E原子的电子层数为n,最外层电子数为2n+l。下列叙述不正确的是( )
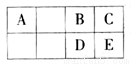
A.C和E氢化物的热稳定性和还原性均依次减弱
B.A与B形成的阴离子可能有AB32-、A2B42-
C.AD2分子中每个原子的最外层均为8电子结构
D.A、D、E的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目: 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:选择题
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中,正确的是( )
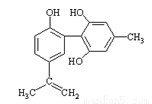
A.滴入酸性高锰酸钾溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
B.1mol该物质分别与浓溴水和H2反应时最多消耗溴水和H2分别为4mol和7mol
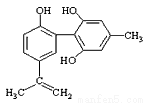 C.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
C.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
D.该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目: 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:选择题
已知热化学方程式:
①2H2(g)+O2(g)=2H2O(l) ∆H= -571.6kJ/mol
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ∆H= -1452kJ/mol
③H+(aq)+OH—(aq)=H2O(l) ∆H= -57.3kJ/mol
据此判断下列说法正确的是( )
A.CH3OH的燃烧热为1452kJ/mol
B.2H2(g)+O2(g)=2H2O(g) ∆H > -571.6kJ/mol
C.2CH3OH(l)+O2(g)=2CO2(g)+4H2(g) ∆H= -880.4kJ/mol
D.CH3COOH(aq)+NaOH(aq)=H2O(l)+CH3COONa(aq) ∆H= -57.3kJ/mol
查看答案和解析>>
科目: 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:选择题
下列实验现象与对应结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 实验1:4mL 0.01mol/L KMnO4酸性溶液+2mL 0.1mol/LH2C2O4溶液+4mL水; 实验2:4mL 0.01mol/L KMnO4酸性溶液+4mL 0.1mol/L H2C2O4溶液+2mL水; 记录褪色时间。 | 实验2先褪色 | H2C2O4浓度越大反应速率越快。 |
B | 用洁净铂丝蘸取无色溶液进行焰色反应 | 火焰呈黄色 | 无色溶液为钠盐溶液 |
C | 向砖红色Ag2CrO4沉淀上滴加0.1mol/LNaCl溶液 | 沉淀变为黑色 | Ksp(Ag2CrO4)>Ksp(AgCl) |
D | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸未发生反应 |
查看答案和解析>>
科目: 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:选择题
二氯化二硫(S2C12)分子中的各原子最外层电子数均满足8电子,易与水反应:
2S2Cl2+2H2O=4HCl+SO2↑+3S↓。对该反应下列说法正确的是( )
A.1molS2C12价电子数为66NA
B.氧化产物与还原产物的物质的量之比为l : 7
C.每生成l mol SO2转移4 NA电子
D.每生成48g硫单质会断裂5NA共价键
查看答案和解析>>
科目: 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:选择题
0.1 mol·L-1HIO3溶液加水稀释的图像如下,下列对该溶液叙述正确的是( )
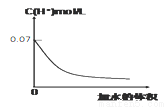
A.若使溶液的pH升高1,可提高溶液的温度
B.若使溶液的pH升高1,将溶液稀释到原体积的10倍
C.0.1 mol·L-1HIO3溶液稀释10倍后,溶液中c(H+)> c(IO3—)> c(HIO3)
D.加水稀释过程中n(HIO3)+n((IO3-)减小
查看答案和解析>>
科目: 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:填空题
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
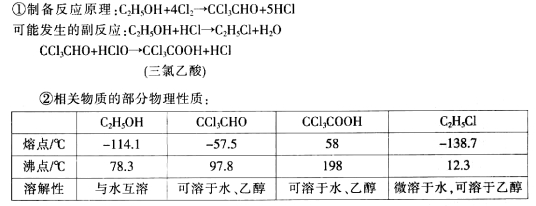
(1)仪器A中发生反应的化学方程式是______;装置B中的试剂是_______。
(2)若撤去装置C,可能导致装置D中副产物_____(填化学式)的量增加;装置D可采用 加热的方法以控制反应温度在70℃左右。
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行,为什么?_______________。
(4)装置E中可能发生的无机反应的离子方程式有_________________。
(5)测定产品纯度:称取产品0.30 g配成待测溶液,加入0.1000 mol·L-1碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000 mo1·L-1Na2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00 mL。则产品的纯度为_________。(CCl3CHO的相对分子质量为147.5)滴定的反应原理:CCl3CHO+OH-==CHCl3+HCOO-、HCOO-+I2==H++2I-+CO2↑ 、I2+2S2O32-==2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka (CH3COOH)= 1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱。
查看答案和解析>>
科目: 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:填空题
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质).某课题以此粉末为原料,资源回收的工艺流程如下:
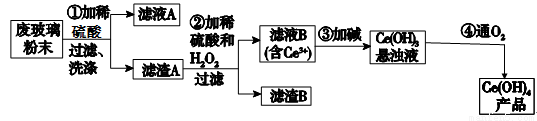
(1)铈(Ce)是稀土元素之一,萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP应满足的条件________________________。
(2)写出第①步反应的离子方程式________________________________,第①步不能用浓盐酸的理由____________________________________________
(3)第①步洗涤滤渣A,检验滤渣A是否洗净的方法是___________________________,写出第②步反应的化学方程式________________________________
(4)工业上利用上述回收的资源以及焦炭、氯气、氢气制取纯硅,写出制取纯硅的相关化学方程式_______________________________________________
(5)取上述流程中得到的Ce(OH)4 产品0.5g ,加硫酸溶解后,用0.1000mol/LFeSO4 标准溶液滴定到终点时( 还原产物为Ce3+ ),消耗20mL 标准溶液,该产品中Ce(OH)4 的质量分数为__________(保留小数点后一位)。
查看答案和解析>>
科目: 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:填空题
氨气在工业上有广泛用途。请回答以下问题:
(1)工业上利用N2(g)+3H2(g)  2NH3(g) ∆H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
2NH3(g) ∆H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①相对a而言,b可能改变的条件是 ,判断的理由是__________________。
②a条件下,0~t0的平均反应速率v(N2)= mol·L-1·min-1。 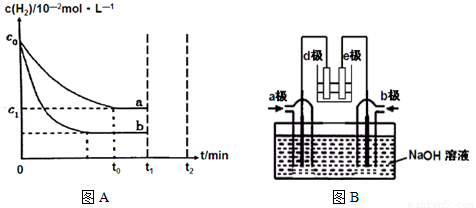
(2)有人利用NH3和NO2构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铝的精炼,如图B所示,e极为精铝。
a极通入 气体(填化学式),判断的理由是___________________________________
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在T2、60MPa下达到平衡。
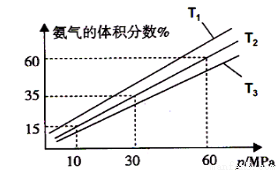
图C
①能判断N2(g)+3H2(g) 2NH3(g)达到平衡的是______(填序号)。
2NH3(g)达到平衡的是______(填序号)。
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②若T1、T2、T3温度下的平衡常数分别为K1、K2、K3,则K1、K2、K3由大到小的排序为 .
③此时N2的平衡分压为 MPa。(分压=总压×物质的量分数)
计算出此时的平衡常数Kp= 。(用平衡分压代替平衡浓度计算,结果保留2位有效数字并带上单位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com