
科目: 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
下列除杂方案错误的是
选项[ | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | FeCl3溶液 | Al3+ | 过量NaOH溶液、盐酸 | 过滤 |
B | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
C | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
D | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
查看答案和解析>>
科目: 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
铜粉放入稀硫酸溶液中,加热后无明显现象发生,当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是
A.KNO3 B.NaCl C.Na2CO3 D.FeSO4
查看答案和解析>>
科目: 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
元素的性质呈周期性变化的根本原因是
A.元素的原子核外电子排布呈周期性变化
B.元素主要化合价呈周期性变化
C.元素的金属性和非金属性呈周期性变化
D.元素的相对原子质量递增,量变引起质变
查看答案和解析>>
科目: 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
依据元素周期表及元素周期律,下列推断正确的是
A.H3BO3的酸性比H2CO3的强
B.Mg(OH)2的碱性比Be(OH)2的强
C.C、N、O原子半径依次增大
D.若M+和R2-的核外电子层结构相同,则原子序数:R>M
查看答案和解析>>
科目: 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
应用元素周期律分析,下列推断正确的是
A.第3周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱
B.砹(At)是第VIIA族元素,其氢化物的稳定性大于HCl
C.第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
D.铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
查看答案和解析>>
科目: 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10,X原子和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强。下列说法错误的是
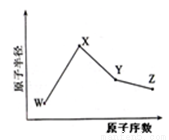
A.对应简单离子半径X<W
B.对应气态氢化物的稳定性Y<Z
C.化合物XZW既含离子键又含共价键
D.Z或X的最高价氧化物对应的水化物均能与Y的氧化物反应
查看答案和解析>>
科目: 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:填空题
最新报道,我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列。已知铯位于元素周期表中第六周期第ⅠA族,根据铯在元素周期表中的位置,推断下列内容:
(1)铯的原子核外共有_____个电子层,最外层电子数为______,铯的原子序数为______。
(2)铯单质与水剧烈反应,放出____色气体,请写出反应的化学方程式:_________________。
(3)预测铯单质的还原性比钠单质的还原性________(填“弱”或“强”)。
查看答案和解析>>
科目: 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:填空题
如表所示是元素周期表示意图的一部分,根据表中10种元素,用元素符号或化学式填空。
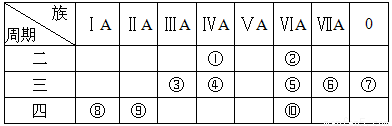
(1)①~⑩元素中,金属性最强的是 (填元素符号);化学性质最不活泼的是 (填元素符号)。
(2)①~⑩元素中,最高价氧化物对应的水化物呈两性的元素是 (填元素符号),该水化物与NaOH溶液反应的离子方程式为 。
(3)①~⑩元素中,最高价氧化物对应的水化物的酸性最强的是 (填化学式),碱性最强的是 (填化学式)。
(4)⑤、⑥、⑧、⑨所形成的简单离子的半径由大到小的顺序是 。(填离子符号)
查看答案和解析>>
科目: 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:填空题
利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
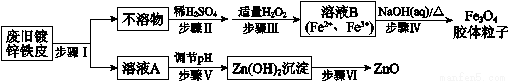
已知:Zn及其化合物的性质与Al及其化合物的性质相似,如:Zn既能溶于强酸又能溶于强碱溶液。
回答下列问题:
(1)步骤I中所用的试剂可以是_________。
(2)步骤III中加入H2O2的作用是做______________。(填“还原剂”或“氧化剂”)
(3)步骤V可选用的试剂是_______(填序号)。
a.NaOH溶液 b.氨水 c.适量HCl溶液
(4)步骤VI的实验操作是_____________。
查看答案和解析>>
科目: 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:实验题
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的化学方程式为________________________________________。
(2)装置A的烧瓶中可装的试剂为___________________。
(3)E装置的作用______________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:_________________________________________________。当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为_______________mol-1(用含a、b的代数式表示)。
从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,实验室常用烧碱溶液吸收Cl2。若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为8︰1时,混合液中NaClO和NaClO3的物质的量之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com