
科目: 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。下列有关化学用语的表示方法中正确的是( )
A.硫原子的原子结构示意图: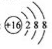
B.NH4Cl的电子式: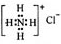
C.原子核内有10个中子的氧原子:
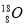
 D.用电子式表示氯化氢分子的形成过程:
D.用电子式表示氯化氢分子的形成过程:
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
反应2A(g) 2B(g)+C(g) △H>0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是( )
2B(g)+C(g) △H>0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是( )
A.减压 B.降温 C.加压 D.增大B的浓度
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
下列说法中错误的是( )
A.有气体参加的化学反应,增大压强,可使单位体积内活化分子百分数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活 化分子之间发生的碰撞不一定为有效碰撞
化分子之间发生的碰撞不一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数增加,从而加快化学反应速率
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)  C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的质量 ③各气体物质的物质的量浓度
④气体的总物质的量⑤混合气体的平均相对分子质量
A.②③⑤ B.①②③ C.②③④⑤ D.①③④⑤
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
A.反应混合物的浓度 B.反应体系的压强
C.正、逆反应的速率 D.反应物的转化率
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)=H2O(1)△H=﹣57.3kJ/mol,则任何酸碱中和的反应热均为57.3 kJ
D.已知2C(s)+2O2 (g)═2 CO2(g)△H1 2C(s)+O2 (g)═2 CO (g)△H2 则△H1<△H2
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
A、B、C、D四种原子序数依次增大的元素,分布在三个不同的短周期,其中B与C为同一周期的相邻元素,A与D为同一主族。C原子的最外层电子数是次外层电子数的3倍,D是所在周期原子半径最大的元素。下列说法正确的是( )
A.离子半径:D>C>B
B.B的氢化物比C的氢化物更稳定
C.C与D可形成化合物D2C2,1mol该物质与水完全反应转移的电子数为NA
D.由A、B、C形成的化合物一定只有共价键没有离子键
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
下列有关热化学方程式及其叙述正确的是 ( )
A.氢气的燃烧热(△H)为-285.5kJ/mo1,则水电解的热化学方程式为:
2H2O(1) =2H2(g)+O2(g) △H=+285.5KJ/mo1
B.1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,它的热化学方程式为
1/2CH4(g)+O2(g)= 1/2CO2(g)+H2O(1) △H=-445kJ/mol
C.已知2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1,则C的燃烧热(△H)为-110.5kJ/mo1
D.HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(1) △H= -57.3kJ/mol
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
短周期元素X、Y的原子序数相差2,下列叙述正确的是( )
A.X与Y不可能位于同一周期
B.X与Y不可能形成原子个数比为1:1型离子化合物
C.X离子与Y离子电子层结构可以相同,也可以不同
D.X与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构
查看答案和解析>>
科目: 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
一定条件下,化学反应2H2+O2===2H2O的能量变化如图所示,则反应的热化学方程式可表示为( )
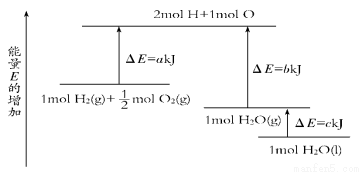
A.H2(g)+1/2O2(g)===H2O(g) ΔH=(a+b) kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=2(b-a) kJ·mol-1
C.H2(g)+1/2O2(g)===H2O(l) ΔH=(b+c-a) kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l) ΔH=2(a-b-c) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com