
科目: 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:选择题
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO、MnO、CO32-、SO42-中的若干种组成,取该溶液进行如下实验:
① 取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液;
② 在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据对上述实验的分析判断,最后得出的结论合理的是( )
A.不能判断溶液中是否存在SO42- B.溶液中一定不存在的离子是CO32-
C.不能判断溶液中是否存在Ag+ D.不能判断是否含有 AlO 离子
查看答案和解析>>
科目: 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:选择题
下列实验方案能达到实验目的的是( )
实验方案 | 实验目的或结论 | |
A | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
B | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀 | 说明Y中不含醛基 |
C | 取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(已转化为标准状况下) | 测定铝箔中氧化铝的含量 |
D | 比较不同反应的反应热数据大小 | 从而判断反应速率的大小 |
查看答案和解析>>
科目: 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.实验室制氢气,为了加快反应速率,可向稀 H2SO4 中滴加少量 Cu(NO3)2 溶液
B.N2(g)+3H2(g)  2NH3(g) ΔH<0,仅升高温度,达平衡时氢气转化率增大
2NH3(g) ΔH<0,仅升高温度,达平衡时氢气转化率增大
C.吸热反应“TiO2(s)+2Cl2(g) =TiCl4(g)+O2(g)”一定条件下可自发进行,则该反应ΔS<0
D.在稀AgNO3溶液中加入过量 NaCl溶液,产生白色沉淀,再加入少量 Na2S溶液,出现黑色沉淀,则加入Na2S溶液后 c(Ag+) 更小了
查看答案和解析>>
科目: 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.油脂发生皂化反应能生成甘油
B.乙炔、丙烯酸(CH2=CHCOOH)、醋酸乙烯酯(CH3COOCH=CH2)均可作为合成聚合物的单体
C.蔗糖及其水解产物均能与新制氢氧化铜反应生成红色沉淀
D.谷氨酸分子  缩合最多形成2种二肽(不考虑立体异构)
缩合最多形成2种二肽(不考虑立体异构)
查看答案和解析>>
科目: 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:实验题
中学常采用高锰酸钾加热分解法制取氧气,某兴趣小组经查阅资料获知:制得氧气后固体残余物中的锰酸钾(K2MnO4)具有强氧化性,与还原剂、有机物、易燃物混合可形成爆炸性混合物,如不妥善处置将造成危险。因此该小组对该残余物进行分离提纯,得到锰酸钾晶体,利用回收的锰酸钾与浓盐酸反应制取氯气,并设计实验验证氯气化学性质。
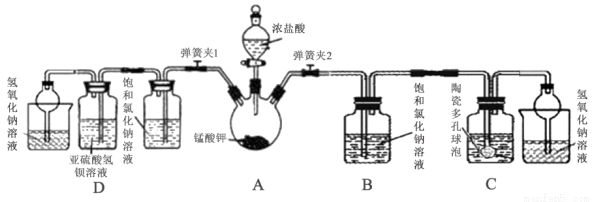
(1)打开分液漏斗活塞及弹簧夹2,观察到烧瓶壁有紫红色物质生成并逐渐消失,黄绿色气体充满烧瓶。反应结束后,烧瓶内有黑色固体残余,写出过程中发生的化学反应方程式:____________。
(2)该方法制取氯气比用纯净的高锰酸钾要缓和平稳许多,试分析原因____________。
(3)该小组利用装置C吸收氯气制备漂白粉。
①C中盛装的试剂为____________;
②陶瓷多孔球泡的作用是____________。
(4)测定漂白粉有效成分的质量分数:称取1.5g所制漂白粉配成溶液,调节pH值并加入指示剂,用0.1000mol/L KI溶液进行滴定,三次平行实验平均每次消耗20.00mL标准液时达到滴定终点,反应原理涉及到的方程式为:3ClO-+I-=3Cl-+ IO3- ; IO3-+5I-+3H2O=6OH-+3I2
①所选的指示剂为____________,达到滴定终点的标志是____________。
②该漂白粉中有效成分的质量分数为____________。
(5)打开分液漏斗活塞及弹簧夹1,可观察到D中的现象为____________ ,该现象能够证明氯气有氧化性。甲同学认为取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,也能证明氯气氧化了亚硫酸氢钡,你认为是否正确并说明理由____________。
查看答案和解析>>
科目: 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:填空题
锂离子电池的广泛应用使得锂电池的回收利用一直是科学家关注的焦点。磷酸铁锂则是锂电池中最有前景的正极材料,磷酸铁是其前驱体,充放电时可以实现相互转化。某研究性小组对废旧锂离子电池正极材料(图中简称废料,成份为LiFePO4、碳粉和铝箔)进行金属资源回收研究,设计实验流程如下:
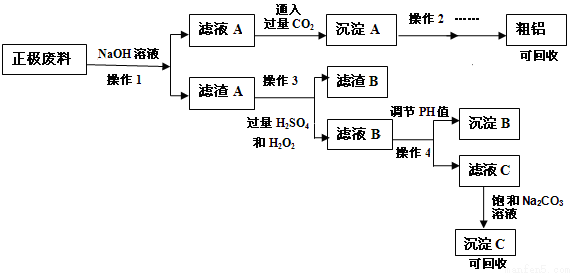
已知:①FePO4可溶于稀H2SO4,不溶于水和其他的酸。
②Li2SO4、LiOH和Li2CO3在273K下的溶解度分别为34.2g、22.7g和1.54g
373K下,Li2CO3的溶解度为0.72g
③Ksp[Al(OH)3]=10-32 Ksp[Fe(OH)3]=4×10-38
(1)可以提高操作1浸出率的方法有(写出3种) 。
(2)完成操作3中的离子方程式: 。
(3)该锂电池充电时的正极反应式: 。
(4)操作4中应选择试剂 将溶液调节pH值至 。
(5)沉淀C的成分
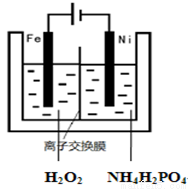
(6)磷酸铁也可以通过电解法制备,如右图,请完成制备过程的总反应离子方程式: 。
查看答案和解析>>
科目: 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:填空题
纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂。目前主要的合成方法有电解法、高温固相法等。
(1)有研究表明阳极氧化法成功制得了Cu2O 纳米阵列,装置如图:
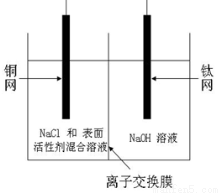
该电池的阳极反应方程式为 离子交换膜为_______(填阳或阴)离子交换膜,铜网应连接电源的_____极。
(2)在高温下用甲烷将粉状CuO 还原也可制得Cu2O。
已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H = -846.3 kJ/mol
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157 kJ/mol
则该反应的热化学方程式是:__________。
(3)在相同的密闭容器中,用等质量的三种纳米Cu2O(用不同方法制得)分别进行催化分解水的实验:2H2O(g)  2H2(g)+O2(g) △H>0。水蒸气浓度随时间t变化如下表所示:
2H2(g)+O2(g) △H>0。水蒸气浓度随时间t变化如下表所示:
序号 |
| 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
①对比实验的温度:T2 T1(填“﹥”“﹤”或“﹦”),原因是___________________。
②实验①前20 min的平均反应速率 v(O2)=
③比较不同方法制得的Cu2O的催化效果应选用__________组实验,原因是___________。
查看答案和解析>>
科目: 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:填空题
中国是世界炼锌的发源地,宋应星著于明崇祯十年(1637年)的《天工开物》一书则是最早记述炼锌技术的典籍。回答下列问题:
Ⅰ.《天工开物》中有关于“升炼倭铅” 的记载:“炉甘石(碳酸锌)十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅(金属锌)也。”
(1)该炼锌工艺过程主要反应的化学方程式为 。
Ⅱ. 目前,工业上主要采用 “湿法炼锌”。以闪锌矿(主要成分为 ZnS ,含有FeS等杂质)为原料冶炼锌的工艺流程如下图所示。
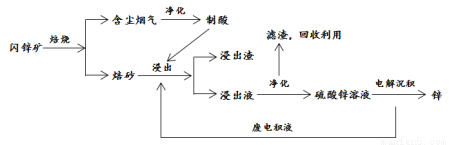
(2)闪锌矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的成分的化学式为 。
(3)焙烧过程中产生的含尘烟气可净化制酸,该酸的名称是 。
工业上常采用“针铁矿法”净化浸出液,在80~100℃,Fe3+浓度低于1g/L,调节浸出液的pH在3~5之间,溶液中的铁可以呈针铁矿(FeOOH)的形式析出。
(4)浸出液的Fe3+浓度较高,应先加入SO2或ZnS将 ,再以ZnO调节酸度,在空气缓慢氧化得 Fe3+,最后Fe3+ 转化成针铁矿沉淀。Fe2+沉淀过程的总离子方程式为 。
(5)电解沉积锌是以Pb-Ag合金惰性电极作阳极、纯铝板作阴极,通以直流电,在 上析出金属锌,电解过程的化学反应方程式为 。
查看答案和解析>>
科目: 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:填空题
磷元素在生产和生活中有广泛的应用。
(1)P原子价电子排布图为__________________________。
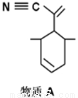
(2)四(三苯基膦)钯分子结构如右图:P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为______;判断该物质在水中溶解度并加以解释_________________________________________。该物质可用于如图所示物质A的合成:物质A中碳原子杂化轨道类型为________________;一个A分子中手性碳原子数目为_______________。
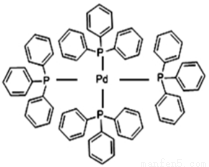
(3)在图示中表示出四(三苯基膦)钯分子中配位键
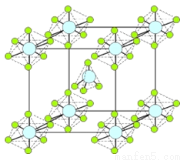
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为 ;正四面体形阳离子中键角小于PCl3的键角原因为____________________________;该晶体的晶胞如右图所示,立方体的晶胞边长为a pm,NA为阿伏伽德罗常数的值,则该晶体的密度为_________g/cm3。
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因 。
查看答案和解析>>
科目: 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:填空题
有机物DBP常用作纤维素树脂和聚氯乙烯的增塑剂,特别适用于硝酸纤维素涂料。具有优良的溶解性、分散性和粘着性。由有机物A和邻二甲苯为原料可以合成DBP。
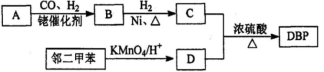
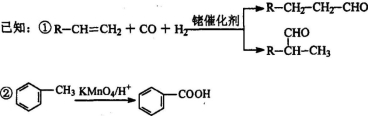
③烃A是有机合成的重要原料。A的质谱图表明其相对分子质量为42,红外光谱表明分子中含有碳碳双键;B能发生银镜反应;有机物C的核磁共振氢谱显示其分子中含有5种化学环境不同的氢原子,且个数之比为3:2:2:2:l。回答下列问题:
(1)A的结构简式为________;A在一定条件下生成聚合物的化学方程式为___________________
(2)D中的含氧官能团是___________。有机物D和足量有机物C反应生成DBP的化学方程式是____________________________________________
(3)下列说法正确的是___________ (选填序号字母)。
A.A能发生聚合反应、加成反应和氧化反应
B.与C互为同分异构体,且含有相同官能团的有机物有2种
C.邻二甲苯能氧化生成D说明有机物分子中基团之间存在影响
D.1 mol DBP可与含4mol NaOH的溶液完全反应
(4)工业上常用有机物E(C8H4O3)代替D生产DBP。反应分为两步进行:
i)E+C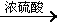 中间产物
中间产物
ii)中间产物+C 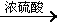 DBP+H2O
DBP+H2O
①请写出E的结构简式___________。
②工业上生产有机物E的反应如下:2X+9O2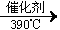 2E+4CO2+4H2O,芳香烃X的一溴代物只有两种,则X的结构简式是___________。
2E+4CO2+4H2O,芳香烃X的一溴代物只有两种,则X的结构简式是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com