
科目: 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构。下列关系正确的是
A.氢化物的稳定性H2Y>HZ
B.离子半径W3+<Z-,第一电离能X<W
C.W、X、Y、Z最高正价与族序数相等
D.电负性Z<Y<W<X
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
甲醛(H2C=O)在Ni催化作用下加氢可得到甲醇(CH3OH),以下说法中正确的是
A.甲醇、甲醛分子间都可以形成氢键
B.甲醇分子内C原子采取sp2杂化,O原子采取sp杂化
C.甲醛为极性分子,分子中两个C—H键夹角小于120°
D.甲醇分子内的O—C—H键角大于甲醛分子内的O—C—H键角
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
有关晶体组成结构的叙述中,正确的是

A.SiO2晶体中最小环上的原子数为6
B.在晶体中只要有阳离子就一定有阴离子
C.12g石墨烯(如图1)中含有六元环的个数为0.5NA
D.720gC60晶体(如图2)中含有0.5NA个晶胞结构单元
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
原理Cr2O72-+CH3CH2OH+H++H2O [Cr(H2O)6]3++CH3COOH(未配平)可用于检测司机是否酒后驾驶,下列说法正确的是
[Cr(H2O)6]3++CH3COOH(未配平)可用于检测司机是否酒后驾驶,下列说法正确的是
A.消耗1molCH3CH2OH时转移电子的物质的量为4mol
B.1mol/LCH3COOH溶液中含有δ键的数目为7NA
C.H2F+、NH2-、H2S、CH4均与H2O互为等电子体
D.在配合物[Cr(H2O)6]3+中,H、O原子与中心离子Cr3+形成配位键
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.P4和CH4的空间构型和键角都相同
B.O3与OF2都是V形分子
C.SO3和SeO32-的立体构型都是三角锥形
D.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
如图为离子晶体空间构型示意图,则离子晶体的组成表达式不正确的是

A.XY B.XY2Z C.XY3 D.X2Y
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
某原子的价电子构型为3s23p2,其核外电子运动说法错误的是
A.有4种不同的伸展方向 B.有5种不同能量的电子
C.有5种不同的运动范围 D.有14种不同运动状态的电子
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
如图是蓝色晶体MxFey(CN)6中阴离子的最小结构单元(图中是该晶体的八分之一),下列说法正确的是

A.该晶体属于离子晶体,M呈+2价
B.该晶体属于分子晶体,化学式为MFe2(CN)6
C.该晶体中与每个Fe3+距离相等且最近的CN-为12
D.该晶体的一个晶胞中含有的M+的个数为4个
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:填空题
下表为元素周期表的一部分,其中的编号代表所对应的元素。请回答下列问题:

(1)⑧号元素的基态原子的价电子排布式是_________________,与其同周期,且基态原子的核外未成对电子数最多的元素是_______________(写出元素符号)。
(2)④号与⑦号元素形成的氧化物的熔点由高到低的是_________________。
(3)①号与③号元素形成的含有18电子的分子为___________(写出名称),该分子中③元素的原子的杂化方式为______________。②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为______________(用对应的元素符号表示)。

(4)下表是某些短周期元素的电负性值:
元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
X值 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.58 | 2.5 | 3.1 |
①通过分析电负性值变化规律,确定N最接近的电负性值范围:________<N<__________
②推测电负性值与原子半径关系是____________________;
③试判断:AlBr3中化学键类型是____________________。
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:填空题
)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是____________。
(2)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
氟 | 氯 | 溴 | 碘 | 铍 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(3)已知高碘酸有两种形式,化学式分别为H5IO6(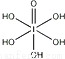 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4(填“>”、“<”或“=”)。
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4(填“>”、“<”或“=”)。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应:I-+I2═I3-.I3-的中心原子周围的σ键电子对对数为______ 。与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列________式发生。
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(5)已知CaF2晶体的密度为ρg·cm3,NA为阿伏加德罗常数,CaF2晶胞的边长为apm,则CaF2的相对分子质量可以表示为________________(用含a的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com