
科目: 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:选择题
迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如下图所示。下列叙述正确的是( )
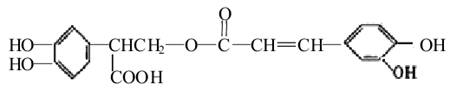
A.迷迭香酸的分子式为C18H15O8
B.迷迭香酸分子中含有5种官能团
C.1mol迷迭香酸跟H2反应,最多可消耗7mol H2
D.迷迭香酸能使酸性高锰酸钾及溴的四氯化碳溶液褪色,属于芳香烃
查看答案和解析>>
科目: 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:选择题
下列坐标图均涉及到平衡原理,其中相关表述正确的是( )

A.图②表示2SO2(g)+O2(g) 2SO3(g) △H<0正逆反应的平衡常数K随温度的变化
2SO3(g) △H<0正逆反应的平衡常数K随温度的变化
B.图③表示反应2NH3(g) 3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
C.图④表示AgCl(s) Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
D.图①表示室温下,用0.1mol·L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3·H2O),虚线表示c(NH4+),处于M点时溶液呈中性
查看答案和解析>>
科目: 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:选择题
某溶液中含有NH4+、Fe2+、Al3+、SO42-、Cl-五种离子,若向其中加入过量的Na2O2,微热并搅拌,再通入过量的HI气体,充分反应后,最后加入足量的硝酸酸化的硝酸钡溶液,则下列叙述不正确的是( )
A.反应后,溶液中NH4+、Fe2+、SO42-的物质的量减少,而Al3+、Cl-的物质的量不变
B.Fe2+先被氧化并形成沉淀,后来沉淀溶解并被还原为Fe2+,最后又被氧化
C.该实验中共有二种气体生成
D.Al3+先形成沉淀后溶解,后来再形成沉淀接着又沉淀溶解
查看答案和解析>>
科目: 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:实验题
苯胺为无色液体,还原性强,易被氧化;有碱性,与酸反应生成盐。常用硝基苯与H2制备: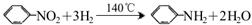 。
。
其部分装置及有关数据如下:
沸点/℃ | 密度g/mL | 溶解性 | |
硝基苯 | 210.9 | 1.20 | 不溶于水,易溶于乙醇、乙醚 |
苯胺 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚 |
乙醚 | 34.6 | 0.71 | 不溶于水,易溶于硝基苯、苯胺 |
实验步骤:
①检查装置的气密性,连接好C处冷凝装置的冷水。
②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压分液漏斗,换上温度计。
③打开装置A、B间活塞,通入H2一段时间。
④点燃B处的酒精灯,加热,使温度维持在140℃进行反应。
⑤反应结束后,关闭装置A、B间活塞,加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。
回答下列问题:
(1)步骤⑥中温度计水银球的位置在__________。
(2)下列关于实验的叙述中,错误的是__________。
A.冷凝管的冷水应该从b进从a出
B.实验开始酎,温度计水银球应插入反应液中,便于控制反应液的温度
C.装置A中应使用锌粉,有利于加快生成H2的速率
D.加入沸石的目的是防止暴沸
(3)若实验中步骤③和④的顺序颠倒,则实验中可能产生的后果是_____________。
(4)蒸馏前,步骤⑤中加入生石灰的作用是____________________。
(5)有学生质疑反应完成后,直接蒸馏得到苯胺的纯度不高,提出以下流程:

苯胺在酸性条件下生成盐酸苯胺被水萃取,在碱性溶液中又被放有机溶剂反萃取,这种萃取——反萃取法简称反萃。实验中反萃的作用是__________;在分液漏斗中进行萃取分液时,应注意不时放气,其目的是____________________。
(6)苯胺还原性强,易被氧化,请配平下列化学方程式的化学计量数。

查看答案和解析>>
科目: 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:简答题
利用含铜、铁的粗锌制备硫酸锌及相关物质。工艺流程图及有关数据如下:

物质 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-38 | 1.2×10-23 | 8.5×10-45 |
请回答下列问题:
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为__________________________,图中处理气体X要能够体现绿色化学思想,还需补充气体______(填化学式)。
(2)若溶液I中c(Cu2+)为0.05mol·L-1,则溶液II中c(Fe3+)>____mol·L-1。
(3)若固体A是Zn,取9.61 g固体C溶解于足量的500mL 2 mol·L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2 mol·L-1 NaOH溶液,则当生成沉淀最多时,沉淀的质量为_____g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为________________________。
(4)溶液Ⅲ经过蒸发浓缩、____________、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是____________(填化学式)。
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH4++Zn=2NH3+H2↑+Zn2+,造成电量自动减少。写出铅蓄电池不使用时,其正极上发生自放电的化学方程式__________________________。
查看答案和解析>>
科目: 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:填空题
近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx,挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g) 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)  CO2(g)+2H2O(g)+N2 (g) △H=_____kJ·mol-1;
CO2(g)+2H2O(g)+N2 (g) △H=_____kJ·mol-1;
(2)在3.0 L密闭容器中,通入0.10 mol CH4和0.20 mol NO2,在一定温度进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表
时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
由表中数据计算0~4min内v(NO2)=_________,该温度下的平衡常数K=________。
(3)在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):
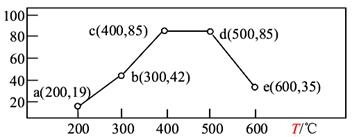
则下列叙述正确的是____________。
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v(逆)>e点的v(逆)
C.平衡常数:c点=d点
D.提高c点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
(4)用0.05 mol·L-1Na2S溶液吸收上述甲烷中含有的H2S气体,当吸收的H2S的物质的量与原Na2S的物质的量相等时溶液显碱性,此时溶液中有关粒子的表达式正确的是( )
A.n(Na+)=0.1 mol B.c(Na+)-c(OH-)>c(S2-)+c(HS-)-c(H+)
C.c(H2S)+c(H+)<c(S2-)+c(OH-) D.c(Na+)-c(H2S)=2c(S2-)+c(HS-)
测得25℃时溶液中的c(H2S)=1.0×10-4mol·L-1,则溶液的pH=________。
(5)将(1)中CH4+2NO2 CO2+2H2O+N2的反应设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-;则电池的正极电极反应式为______________。
CO2+2H2O+N2的反应设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-;则电池的正极电极反应式为______________。
查看答案和解析>>
科目: 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:简答题
[化学—选修2:化学与技术]粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等。一种利用粉煤灰制取氧化铝的工艺流程如下 :
:
(1)粉煤灰研磨的目的是_______________________。
(2)第1次过滤时滤渣的主要成分有__________、__________(填化学式,下同),第3次过滤时滤渣的成分是__________。
(3)在104℃用硫酸浸取时,铝的浸取率与时间关系如图1,适宜的浸取时间为__________h;铝的浸取率与 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在 相同时,浸取率最高的是__________(填助溶剂化学式);用含氟的化合物作这种助溶剂的缺点是__________(举一例)。
相同时,浸取率最高的是__________(填助溶剂化学式);用含氟的化合物作这种助溶剂的缺点是__________(举一例)。

(4)流程中循环使用的物质有__________。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出AlCl3·6H2O,请简要说明该过程能够发生的原因____________________。
(6)用粉煤灰制取含铝化合物的主要意义是____________________。
查看答案和解析>>
科目: 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:填空题
(化学—选修3:物质结构与性质)
氮化硼(BN)被称为一种“宇宙时代的材料”,具有很大的硬度。
(1)基态硼原子有__________个未成对电子,氮离子的电子排布式为__________。
(2)部分硼的化合物有以下转化: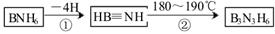
则下列叙述正确的是__________(填序号);
A.B3N3H6俗称无机苯,但不是平面分子
B.BNH6与乙烷是等电子体
C.HB≡NH中的硼原子、氮原子韵杂化类型相同
D.硼、氮、氧三元素的第一电离能比较:B<N<O
(3)下图的晶体结构中,黑球白球分别代表不同的原子、离子或分子,则图1的晶胞中含有的粒子总数为__________;图2中的白球的配位数是__________。
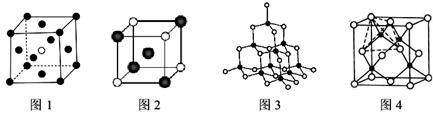
(4)已知图3、4均表示BN晶体的结构,制备氮化硼的原理为:BCl3+2NH3=BN+2HCl+NH4Cl,当该反应中有1mol BN生成时,则反应中可形成__________mol配位键,比较氮化硼晶体与晶体硅的沸点高低并解释原因____________________。
(5)X射线的衍射实验可获取晶体的结构,包括晶胞形状、大小及原子的分布等参数,从而提供了又一种实验测定阿伏加德罗常数和元素的相对质量的方法。若图4晶胞的棱长为a nm,密度为ρ g·cm-3,则阿伏加德罗常数为__________(要求化为最简关系)。
查看答案和解析>>
科目: 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:推断题
[化学—选修5:有机化学基础]下图为阿托酸甲酯的一种合成路线:

请回答下列问题:
(1)已知A为芳香烃,其核磁共振氢谱中出现5个蜂,其面积比为1∶1∶2∶2∶2,则A的名称为__________,若要检验有机物B的官能团,则所使用的试剂除了有机物B和水之外,还需要的试剂有__________(填化学式)。
(2)写出有关的化学方程式
反应②______________________________;
反应③______________________________。
(3)阿托酸甲酯所含官能团的名称为__________;阿托酸甲酯有多种同分异构体,其中苯环上只有一个支链,既能与NaHCO3溶液反应,又能使溴的四氯化碳溶液褪色的同分异构体有__________种(不考虑立体异构)。
(4)阿托酸甲酯的另外一种合成路线如下图所示:

已知在多步反应过程中进行了下列4种不同的反应类型,请按照实际进行的反应顺序依次写出这四种反应类型的字母序号__________。
A.取代反应 B.消去反应 C.加成反应 D.氧化反应
查看答案和解析>>
科目: 来源:2016届辽宁省高三下第四次模拟理综化学试卷(解析版) 题型:选择题
化学与社会、生活、生产联系广泛。下列说法正确的是( )
A.高铁酸钾处理水的原理与明矾完全相同
B.推广煤的气化和液化技术,能减少二氧化碳的排放
C.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于新型无机非金属材料
D.食品安全包括限制添加剂的种类和添加的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com