
科目: 来源:2016届重庆市高三5月模拟考试理综化学试卷(解析版) 题型:选择题
右图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A.31d和33d属于同种核素
B.气态氢化物的稳定性:d>a>e
C.工业上常用电解法制备单质b和c
D.a和b形成的化合物不可能含共价键
查看答案和解析>>
科目: 来源:2016届重庆市高三5月模拟考试理综化学试卷(解析版) 题型:选择题
一种处理污水的燃料电池模型如下图所示。该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙。下列叙述不正确的是
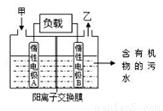
A.B电极为正极
B.气体乙可能为CO2
C.O2在A电极得电子
D.电池工作时,B电极附近的pH逐渐减小
查看答案和解析>>
科目: 来源:2016届重庆市高三5月模拟考试理综化学试卷(解析版) 题型:选择题
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是

A.该弱酸在滴定前的浓度大于0.001mol/L
B.由滴定起点数据可计算该弱酸的Ka(电离平衡常数)为2×10-5
C.滴定过程为求滴定终点,最合适的指示剂是酚酞
D.滴定终点时,c(Na+) >c(A-) > c(OH-) >c(H+)
查看答案和解析>>
科目: 来源:2016届重庆市高三5月模拟考试理综化学试卷(解析版) 题型:选择题
下列实验中,对应的现象和结论都正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向某溶液滴加过量的稀盐酸 | 有刺激性气味气体产生,溶液中出现淡黄色沉淀 | 溶液中一定存在S2-和SO32- |
B | 向KI溶液中加热淀粉,然后再加入1.0mol•L-1的H2SO4溶液 | 开始时无明显现象,加入H2SO4溶液后溶液变蓝 | H2SO4能氧化I- |
C | 将石蜡油(烷烃混合物)蒸汽通过炽热的碎瓷片,再将生成的气体通入溴水中 | 溴水褪色 | 石蜡油被催化裂解,生成了不饱和烃 |
D | 分别向等浓度的Na2CO3与NaHCO3溶液中加入等量的盐酸 | NaHCO3溶液中产生气泡的速率更快 | CO32-结合H+能力比HCO3-弱 |
查看答案和解析>>
科目: 来源:2016届重庆市高三5月模拟考试理综化学试卷(解析版) 题型:实验题
青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
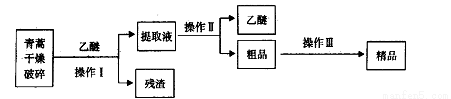
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、___________,操作Ⅱ的名称是_________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
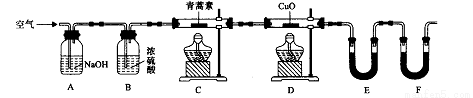
①装置E中盛放的物质是____________,装置F中盛放的物质是______________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:
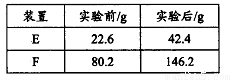
则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:
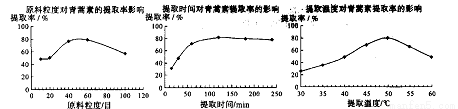
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目: 来源:2016届重庆市高三5月模拟考试理综化学试卷(解析版) 题型:简答题
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)已知H3AsO3是两性偏酸性的化合物,H3AsO3中As的化合价为_____,它与足量硫酸反应时生成盐的化学式为_______________。Na2HAsO3溶液呈碱性,原因是_________________(用离子方程式表示),该溶液中c(H2AsO3-) _____c(AsO33-)(填”>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷、鉴定砒霜(As2O3)的原理如下图:

反应a产生的废气直接排放可能带来的环境问题是__________ _____,请写出反应b的化学方程式:_________________________。
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为_________。
③向c(As3+)=0.01mol/L的工业废水中加入FeS固体至砷完恰好完全除去(小于1×10-5mol/L),则此时c(Fe2+)=_____mol/L。(已知Ksp(As2S3)=1×10-22,Ksp(FeS)=6×10-18)
(3)某原电池装置如右图,电池总反应为AsO43-+2I-+H2O AsO33-+I2+2OH-当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。
AsO33-+I2+2OH-当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。

查看答案和解析>>
科目: 来源:2016届重庆市高三5月模拟考试理综化学试卷(解析版) 题型:简答题
合成氨工业上常用下列方法制备H2:
方法①:C(s)+2H2O(g) CO2(g)+2H2(g)
CO2(g)+2H2(g)
方法②:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
②2C(石墨)+O2(g)═2CO2(g)△H=-222kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
试计算25℃时由方法②制备1000gH2所放出的能量为______kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g) CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:
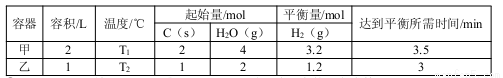
①T1______T2(填“>”、“=”或“<”);T1℃时,该反应的平衡常数K=______。
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是______。
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是______。
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
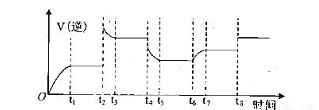
在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是________________________,从t1到t8哪个时间段H2O(g)的平衡转化率最低______。
查看答案和解析>>
科目: 来源:2016届重庆市高三5月模拟考试理综化学试卷(解析版) 题型:简答题
[化学-选修2:化学与技术]碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料。请根据题意回答下列问题:
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法。其流程如下:

(1)流程I的另一产物是____,流程Ⅱ的反应分步进行:a. 
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为__________________。
Ⅱ.1862年,比利时人索尔维(ErnestSolvay)用氨碱法生产碳酸钠。反应原理如下:

20℃时一些物质在水中的溶解度/g•(100gH2O)

(2)氨碱法生成纯碱的原料是____________,可循环利用的物质有____________。
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:_________、__________、_________。
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原
料利用率。

(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在________(填温度范围)下析出________(填化学式)。
查看答案和解析>>
科目: 来源:2016届重庆市高三5月模拟考试理综化学试卷(解析版) 题型:填空题
[化学-选修3:物质结构与性质] 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸。发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是___ ____(填元素符号),解释原因_____________________________________________。
(2)二甲基二硫和甲酸中,在水中溶解度较大的是_____ _(填名称),原因是_____________;烧碱所属的晶体类型为________;硫化碱(Na2S)的S2-的基态电子排布式是________________。
(3)硝酸铵中,NO3-的立体构型为 ,中心原子的杂化轨道类型为___________。
(4)1mol化合物NaCN中CN-所含的π键数为______,与-CN互为等电子体的分子有 。(CN)2又称为拟卤素,实验室可以用氰化钠、二氧化锰和浓硫酸在加热条件下制得,写成该制备的化学方程式___ _______。

(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________;晶胞中K 原子的配位数为 ;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 __________(列出计算式,不需要计算出结果)。
查看答案和解析>>
科目: 来源:2016届重庆市高三5月模拟考试理综化学试卷(解析版) 题型:推断题
[化学-选修5:有机化学基础]
可由N物质通过以下路线合成天然橡胶和香料柑青酸甲酯衍生物F

已知:
(1)用系统命名法对N命名 .
(2)①试剂a的名称是________。 ②C D中反应i的反应类型是________。
D中反应i的反应类型是________。
(3)E的结构简式是_____________。
(4)关于试剂b的下列说法不正确是________(填字母序号)。
a. 存在顺反异构体 b. 难溶于水
c. 能发生取代、加成和氧化反应 d. 不能与NaOH溶液发生反应
(5)写出A生成B的反应方程式 。
(6)分子中含有 结构的D的所有同分异构共有________种(含顺反异构体),写出其中任意一种含反式结构的结构简式________。
结构的D的所有同分异构共有________种(含顺反异构体),写出其中任意一种含反式结构的结构简式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com