
科目: 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
氨甲环酸和氨甲苯酸是临床上常用的止血药,其结构如图:下列说法错误的是( )

A.氨甲环酸、氨甲苯酸都既能溶于盐酸,又能溶于NaOH溶液
B.氨甲环酸、氨甲苯酸都能发生取代、氧化、缩聚等反应
C.氨甲环酸、氨甲苯酸中各有5种不同的氢原子
D.氨甲苯酸属于芳香族a-氨基酸的同分异构体和苯丙氨酸互为同系物
查看答案和解析>>
科目: 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:实验题
实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是( )
选项 | 实验目的 | 主要仪器 | 试剂 |
A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
B | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
C | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
查看答案和解析>>
科目: 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O) > c(NH4+)> c(Cl-)> c(OH-)
C.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
D.0.1 mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: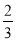 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目: 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
向甲、乙两个容积均为1L的恒容容器中,分别充入2 molA、2 mol B和1 molA、1 molB。相同温度下.发生反应:A(g)+B(g)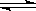 xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是
xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是

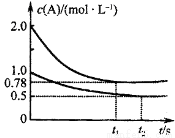
A.甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙)
B.x不可能等于2
C.将乙容器升温可使甲、乙容器内各物质的体积分数相同
D.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol/L<c(A)<1.56 mol/L
查看答案和解析>>
科目: 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:实验题
KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主要步骤:
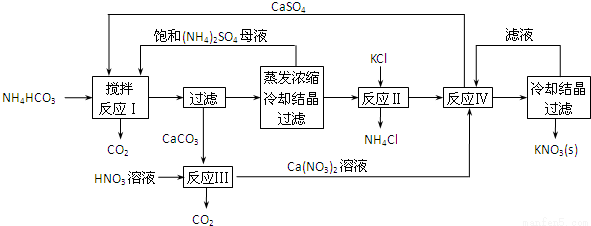
(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1:2,该反应的化学方程式为____________。
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是____________;从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是____________。
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,____________。
(4)整个流程中,可循环利用的物质除(NH4)2SO4外,还有____________(填化学式)。
查看答案和解析>>
科目: 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:实验题
莫沙朵林是一种镇痛药,它的合成路线如下:
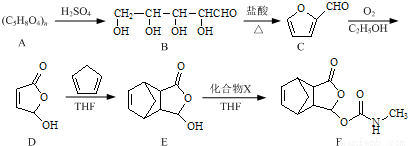
(1)B中手性碳原子数为____________;化合物D中含氧官能团的名称为____________。
(2)C与新制氢氧化铜反应的化学方程式为____________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:____________
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应.
(4)已知E+X→F为加成反应,化合物X的结构简式为____________。
(5)已知: .化合物
.化合物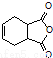 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以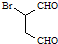 和
和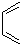 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下: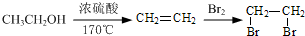 。
。
查看答案和解析>>
科目: 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:实验题
直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4)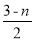 ]m(n>2,m≤10)的实验流程如下:
]m(n>2,m≤10)的实验流程如下:

已知:盐基度=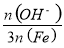 ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
(1)实验加入硫酸的作用是____________,取样分析Fe2+浓度,其目的是____________。
(2)用pH试纸测定溶液pH的操作方法为____________,若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数____________(填“偏高”、“偏低”、“无影响”)
(3)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]?[Fe2(OH)n(SO4)3-n/2]m,则水解反应的化学方程式为____________.
(4)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c mol•L-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为____________。
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为____________。
查看答案和解析>>
科目: 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:填空题
甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.
Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是____________。
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是____________。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是____________。
(4)实验时需强力搅拌45min,其目的是____________;结束后需调节溶液的pH 7~8,其目的是____________,最后经结晶分离、干燥得产品.
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合右图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)。
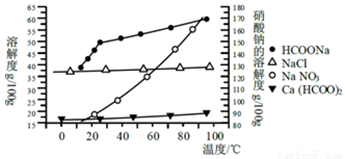
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
请补充完整由碳酸钙制备甲酸钙的实验方案:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用;____________。
提供的试剂有:a.甲酸钠,B.5mol•L-1硝酸,C.5mol•L-1盐酸,D.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水。
查看答案和解析>>
科目: 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
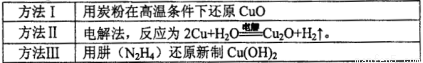
①工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法I,其原因是____________。
②已知:
2Cu(s)+1/2O2(g)═Cu2O(s)△H=-169kJ•mol-1,
C(s)+1/2O2(g)═CO(g)△H=-110.5kJ•mol-1,
Cu(s)+1/2O2(g)═2CuO(s)△H=-157kJ•mol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu20(s)+CO(g); △H=____________kJ/mol。
(2)氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4.
该反应每转移3mol电子,生成CuH的物质的量为____________。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图所示。
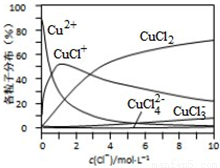
①当c(Cl-)=9mol•L-1时,溶液中主要的3种含铜物种浓度大小关系为____________。
②在c(Cl-)=1mol•L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为____________(任写一个).
(4)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
①在铜盐溶液中Cu2+发生水解反应的平衡常数为____________,(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3•L-3)
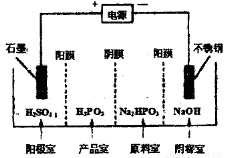
②电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过),则产品室中反应的离子方程式为____________。
查看答案和解析>>
科目: 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:填空题
【选做题】本题包括A, B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分
A.在5-氨基四唑(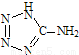 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
(1)基态Ga原子的电子排布式可表示为____________;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为____________,其中N原子的杂化类型为____________;在1mol 5-氨基四唑中含有的σ键的数目为____________。
(3)叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为____________。
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物.其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为____________。
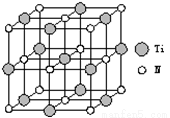
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com