
科目: 来源:2015-2016学年河北省高一下学期期中考试化学试卷(解析版) 题型:选择题
某学生欲完成反应Cu+H2SO4===CuSO4+H2↑而设计了下列四个实验,你认为可行的是( )
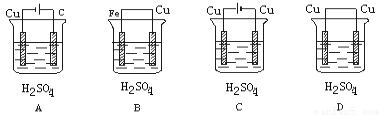
查看答案和解析>>
科目: 来源:2015-2016学年河北省高一下学期期中考试化学试卷(解析版) 题型:选择题
铜板上铁铆钉处的吸氧腐蚀原理如右图所示,下列有关说法中,不正确的是( )

A.正极电极反应式为:2H++2e—→H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
查看答案和解析>>
科目: 来源:2015-2016学年河北省高一下学期期中考试化学试卷(解析版) 题型:填空题
X、Y、Z、W四种元素在元素周期表中序数逐渐增大。X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z的元素名称分别是:
(2)有X、Y、Z所形成的离子化合物是 它与W的最高价氧化物对应水化物的溶液加热时反应的离子方程式是
查看答案和解析>>
科目: 来源:2015-2016学年河北省高一下学期期中考试化学试卷(解析版) 题型:填空题
有X、Y、Z、T、U五种短周期元素。X、Y、Z三元素在周期表中的位置如下所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
X | |
Y | Z |
(1)各元素的符号是:Z________,T________
(2)Y原子的结构示意图为____________________,U2X的电子式
(3)YX2和U2Y反应的化学方程式为____________________________,其中氧化剂是____________,被氧化的元素是____________。
查看答案和解析>>
科目: 来源:2015-2016学年河北省高一下学期期中考试化学试卷(解析版) 题型:填空题
反应:N2(g)+3H2(g) 2NH3(g)在恒温恒容条件下进行,下列情况中,处于平衡状态的是 ;无法判断是否达到平衡的是 。
2NH3(g)在恒温恒容条件下进行,下列情况中,处于平衡状态的是 ;无法判断是否达到平衡的是 。
A.单位时间内消耗2 mol N2,同时生成4 mol NH3
B.单位时间内消耗3 mol H2,同时生成2 mol NH3
C.单位时间内生成2 mol N2,同时形成6 mol N—H键
D.混合气的密度不再随时间而改变
E.容器中气体的压强不再随时间而改变
查看答案和解析>>
科目: 来源:2015-2016学年河北省高一下学期期中考试化学试卷(解析版) 题型:填空题
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
② Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,
① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 ,电极反应式是 。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目: 来源:2015-2016学年河北省高一下学期期中考试化学试卷(解析版) 题型:实验题
为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如下表,t表示收集a mL O2所需的时间。
序号 | 反应 温度/℃ | c(H2O2)/ mol·L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究________________________对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验________和实验________(填序号)作对比。
(3)将实验1和实验2作对比,t1________t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-===2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1 mol·L-1 KI溶液 ②0.1 mol·L-1 FeCl3溶液
③0.1 mol·L-1 FeCl2溶液 ④0.1 mol·L-1 盐酸
⑤0.1 mol·L-1 KSCN溶液 ⑥CCl4
实验步骤:(1)取5 mL 0.1 mol·L-1 KI溶液,再滴加几滴0.1 mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘
(4)另取一份,加试剂________(填序号),现象________________________,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在100 mL密闭容器中投入0.01 mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如下图所示。

(1)反应容器中最后剩余的物质有________________,其中N2O4的物质的量为________mol。
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,从开始到平衡建立这段时间的平均反应速率为________。
查看答案和解析>>
科目: 来源:2015-2016学年河北省邯郸市大名等四县高二下学期期中联考化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的作用.下列有关说法正确的是( )
A.“地沟油”经过加工处理后,可以用来制肥皂
B.二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白
C.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
D.含磷污水是很好的肥料,可灌溉庄稼,可直接排放到自然界水体中
查看答案和解析>>
科目: 来源:2015-2016学年河北省邯郸市大名等四县高二下学期期中联考化学试卷(解析版) 题型:选择题
设NA 为阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,6.4 g O2和O3的混合气体中含有的分子数为0.4NA
B.0.1 mol Fe与少量氯气反应生成FeCl2,转移电子数为0.2 NA
C.1.4 g由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3 NA
D.0.1 mol·L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com