
科目: 来源:2016届山西省高三第二轮训练三化学试卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是
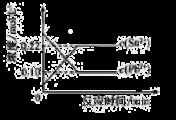
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H﹥0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目: 来源:2016届山西省高三第二轮训练三化学试卷(解析版) 题型:选择题
某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g) →PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0064 mol/(L·s)
B.若保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的△H﹤0
C.相同温度下,起始时向该容器中充入 4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于 80%
D.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
查看答案和解析>>
科目: 来源:2016届山西省高三第二轮训练三化学试卷(解析版) 题型:选择题
某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g) 3Z(g)。平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g)。平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.第二次平衡时,Z的浓度为0.4 mol·L-1
C.两次平衡的平衡常数相同
D.X与Y的平衡转化率之比为1∶1
查看答案和解析>>
科目: 来源:2016届山西省高三第二轮训练三化学试卷(解析版) 题型:选择题
室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是
A.0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
B.向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
C.向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
D.0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
查看答案和解析>>
科目: 来源:2016届山西省高三第二轮训练三化学试卷(解析版) 题型:填空题
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1mol•L?1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O, 250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H= kJ·mol?1。
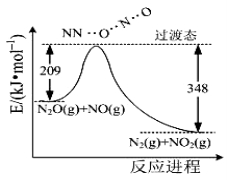
查看答案和解析>>
科目: 来源:2016届山西省高三第二轮训练三化学试卷(解析版) 题型:简答题
氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是 。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是 。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
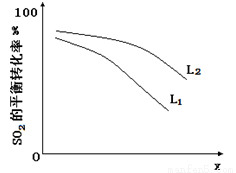
①X代表的物理量是 。
②判断L1、L2的大小关系,并简述理由: 。
查看答案和解析>>
科目: 来源:2016届山西省高三第二轮训练三化学试卷(解析版) 题型:填空题
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式: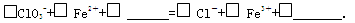
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。
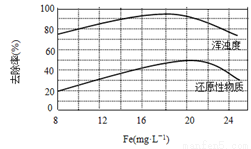
查看答案和解析>>
科目: 来源:2016届山西省高三第二轮训练三化学试卷(解析版) 题型:填空题
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度 /mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①可以判断该分解反应已经达到化学平衡的是___________;
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数___________;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温 下压缩容器体积,氨基甲酸铵固体的质量___________(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H______0(填“﹥”、“=”或“﹤”);焓变△S______0(填“﹥”、“=”或“﹤”)。
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
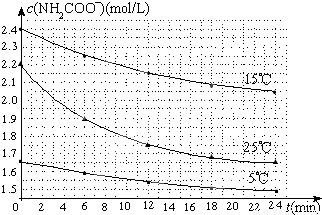
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率______________;
⑥根据图中信息,如何说明水解反应速率随温度升高而增大_____________________。
查看答案和解析>>
科目: 来源:2016届西藏日喀则一中高三下学期二模考试理综化学试卷(解析版) 题型:选择题
下表中相关物质的信息都正确的一项是( )
选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
B | H2O2 |
| 不稳定,易分解 | 医用消毒剂 |
C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
查看答案和解析>>
科目: 来源:2016届西藏日喀则一中高三下学期二模考试理综化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数的值.下列说法正确的是( )
A.1 mol-OH(羟基)与l mol NH4+中所含电子数均为10NA
B.25℃时,100 mL pH=l的稀硫酸中,含有的H+数目为0.01 NA
C.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1 NA
D.标准状况下,2.24LNO2和N2O4混合气体中含0.2 NA个氧原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com