
科目: 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:选择题
下列叙述中,错误的是( )
A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B.苯乙烯在合适条件下催化加氢可生成乙基环己烷
C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D.甲苯与氯气在光照下反应主要生成2,4,6—三氯甲苯
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:选择题
镁电池毒性低、污染小,电压高且平稳,它逐渐成为人们研究绿色电池的关注焦点。其中一种镁电池的反应原理为:xMg+ Mo3S4 MgxMo3S4,下列说法正确的是( )
MgxMo3S4,下列说法正确的是( )
A.放电时Mo3S4发生氧化反应
B.放电时,正极反应式为:Mo3S4 + 2xe- = Mo3S42x-
C.充电时,电路中通过2mol电子时,可消耗1mol Mg
D.充电时,Mg2+向负极移动
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.1mol NaHSO4晶体含有2NA个离子
B.1L2mol/L明矾溶液经水解可得到氢氧化铝胶体粒子的数目为2NA个
C.1mol CH3+(碳正离子)中含有的电子数为10NA
D.在O2参与的反应中,1molO2 作氧化剂时得到的电子数一定是4NA
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:选择题
关于下图所示转化关系(X代表卤素),说法不正确的( )
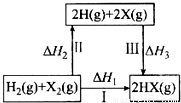
A.H2(g)+X2(g) = 2H(g)+2X(g) △H2>0
B.若X 分别表示Cl、Br、I,则过程Ⅱ吸收的热量依次减少
C.生成HX的反应热与途径有关,所以△H1≠△H2+△H3
D.Cl2、Br2 分别发生反应Ⅰ,同一温度下的平衡常数分别为K1、K2,则K1>K2
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:选择题
已知X、Y、Z、W、R五种元素,原子序数依次增大,且原子序数都小于20,X元素的原子是所有元素中原子半径最小的,Y、W同主族,Z、W同周期,Y元素原子的最外层电子数是次外层的3倍,Z、R是同周期中金属性最强的元素。下列说法不正确的是( )
A.原子半径:X<Y<Z<W<R
B.由X、Y、Z、W四种元素组成的化合物既含有共价键又含离子键
C.沸点:X2Y>X2W
D.Y与W形成的化合物WY2是形成酸雨的主要物质之一
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:填空题
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
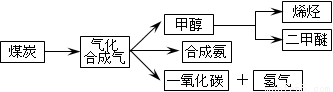
I.已知该产业链中某反应的平衡表常数达式为:K=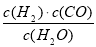 ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中总反应的热化学方程式为 。
830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a= mol/L。
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol/L) | 0.8 | 1.24 | 1.24 |
①此时刻v正 v逆(填“大于”“小于”或“等于”)
②平衡时二甲醚的物质的量浓度是 。
(4)以二甲醚、空气、KOH 溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ;若以1.12L/min(标准状况)的速率向电池中通入二甲醚,用该电池电解500mL2mol/L CuSO4溶液,通电0.50 min后,计算理论上可析出金属铜的质量为 。
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:填空题
某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用。某校研究小组尝试回收废旧正极材料中的钴。
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
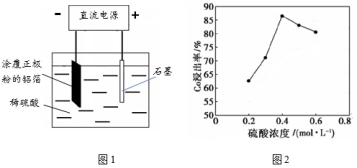
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、 。
阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol/L时,钴的浸出率下降,其原因可能为
。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式: 。该步骤一般在80℃以下进行,温度不能太高的原因是 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
A.c(NH4+) > c(C2O42-) > c(H+) > c(OH-)
B.c(H+) + c(NH4+) = c(C2O42-) + c(OH-) + c(HC2O4-)
C.c(NH4+) + c(NH3·H2O) = 2[c(C2O42-) + c(HC2O4-) + c(H2C2O4 )]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2 的质量分数为a%,则回收后得到CoC2O4·2H2O 的质量不高于 g。
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:实验题
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):
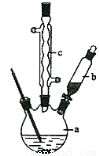
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是 。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是 ,最终得到40 g纯品,则苯乙酸的产率是 (保留3位有效数字)。
(4)用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:填空题
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有 、 。
(2)天然水在净化处理过程中加入的混凝剂可以是 (填2种),其净水作用的原理是 。
(3)水的净化和软化的区别是 。
(4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然水中c(Ca2+)=1.2×10-3mol/L ,c(Mg2+)=6×10-4mol/L ,则此水的硬度为 。
(5)若(4)中的天然水还含有c(HCO3-)=8×10-4mol/L ,现要软化10m3这种天然水,则需先加入Ca(OH)2 g ,后加入Na2CO3 g 。
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:填空题
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数是D的2倍。F元素在地壳中含量位于金属元素的第二位。回答下列问题:
(1)F元素价层电子排布式为 。
(2)关于B2A2的下列说法中正确的是
A.B2A2 中的所有原子都满足8电子结构
B.每个B2A2分子中  键和
键和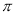 键数目比为1:1
键数目比为1:1
C.B2A2 是由极性键和非极性键形成的非极性分子
D.B2A2分子中的A—B键属于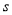 —
—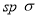 键
键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的结构式为
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能都高的主要原因是
(5)D的氢化物比E的氢化物沸点高,其主要原因是 ;E的氢化物的价层电子对互斥模型为 ,E原子的杂化方式为 。
(6)F单质的晶体在不同温度下有两种堆积方式,即面心立方堆积和体心立方堆积,其晶胞的棱边长分别为a cm、b cm,则F单质的这两种晶体密度之比为 ,F原子的配位数之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com