
科目: 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法正确的是(m、n 均为正整数)
A.离子半径:Rn+ >Zm-
B.若Y的最高价氧化物对应的水化物HnYOm为强酸,则X的氢化物沸点一定比Y的氢化物的沸点低
C.若X的气态氢化物能使湿润的石蕊试纸变蓝,则标准状况下,18g Y的氢化物的体积为2.24 L
D.若R(OH)n为弱电解质,则W(OH)n+1可与KOH溶液反应
查看答案和解析>>
科目: 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
用下图所示装置检验生成气体时,不能达到目的的是

选项 | 生成的气体 | 试剂X | 试剂Y |
A | 电石与水反应制取的乙炔 | CuSO4溶液 | 溴水 |
B | 木炭与浓H2SO4加热得到的二氧化碳 | 饱和NaHCO3溶液 | 澄清石灰水 |
C | CH3CH2Br与NaOH醇溶液共热得到的乙烯 | 水 | KMnO4 酸性溶液 |
D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | 溴水 |
查看答案和解析>>
科目: 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
用石墨电极电解CuCl2溶液(见右图),下列分析正确的是
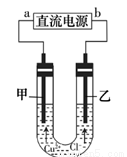
A.b端是直流电源的负极
B.用湿润的KI一淀粉试纸检验甲电极产物
C.通电一段时间后,在阴极附近观察到黄绿色气体
D.若将甲电极换成铁棒,乙电极换成铜棒,则可实现在铁棒上镀铜
查看答案和解析>>
科目: 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
下表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HC1O | H2CO3 |
KSp 或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10 -5 | Ka=3.0×10-8 | Ka1=4.1×10一7 Ka =5.6×10-11 |
A.相同浓度CH3COONa和Na2CO3的混合液中,各离子浓度的关系有:
c(Na+ )>c(CO32- )>c(CH3COO一)>c(OH-)>c(H+)
B.向0.1 mol/LCH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时 c(CH3COO) : c(CH3COO 一)=9 : 5
C.少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D.向浓度均为1×10-3mol/L的KC1和K2CrO4混合液中滴加1×10-3mol/L的AgNO3溶液,CrO42-先形成沉淀
查看答案和解析>>
科目: 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
2015年10月,屠哟哟获得诺贝尔生理学或医学奖,理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率。她成为首获科学类诺贝尔奖的中国人。青蒿素两步可合成得到治疗疟疾的药物青蒿琥酯。下列有关说法正确的是

A.青蒿素分子式为C15H24O5
B.反应②原子利用率为100%
C.该过程中青蒿素生成双氢青蒿素属于氧化反应
D.1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠
查看答案和解析>>
科目: 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
一定条件下合成乙烯6H2(g) + 2CO2(g) CH2=CH2(g) + 4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) + 4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
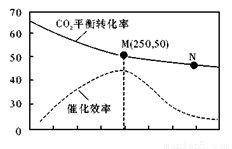
A.生成乙烯的速率: >
>
B.平衡常数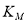 <
<
C.催化剂可能会影响CO2的平衡转化率
D.若投料比n(H2):n(CO2)=3:1,则图中M点时,CO2的体积分数约为15.4%
查看答案和解析>>
科目: 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
中学化学二氧化锰常作催化剂和氧化剂,在下列四种溶液中,分别加入少量固体二氧化锰,能产生气体的是
A.3%H2O2溶液 B.0.1mol•L-1 NaOH 溶液
C.0.1 mol/LKClO3 溶液 D.0.1 mol/L盐酸
查看答案和解析>>
科目: 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
常温下,相同pH的氢氧化钠和醋酸钠溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如右图所示,则下列叙述正确的是
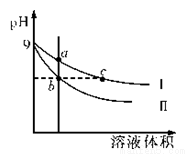
A.b、c两点溶液的导电能力相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c 点溶液中 c(H+ )=c(OH-)+c(CH3COOH)
D.用等浓度的盐酸分别与等体积的b)处溶液恰好完全反应,消耗盐酸体积 Vb=Vc
查看答案和解析>>
科目: 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
—定条件下,合成氨反应为:N2(g)十3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时 间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时 间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是

A.升高温度,该反应的平衡常数增大
B.由图2信息,10 min内该反应的平均速率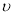 (H2)=0.09 mol • L-1 • min-1
(H2)=0.09 mol • L-1 • min-1
C.由图2信息,从11 min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d
D.图3中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com