
科目: 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:选择题
下列有关物质性质的说法正确的是( )
A.铝与Fe2O3发生铝热反应后固体物质质量不变
B.Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到
C.过量的铜与浓硝酸反应可生成NO
D.由于铝元素和铁元素都有+3价,由2Al+6HCl2=AlCl3+3H2↑可知:2Fe+6HCl2=FeCl3+3H2↑
查看答案和解析>>
科目: 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:选择题
Zn(OH)2是两性氢氧化物,和强酸反应时生成Zn2+,跟强碱反应时生成ZnO22-。现有三份等物质的量浓度、等体积的MgCl2、ZnCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液,分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如下图所示,则与MgCl2、ZnCl2、AlCl3三种溶液一一对应的正确图象是
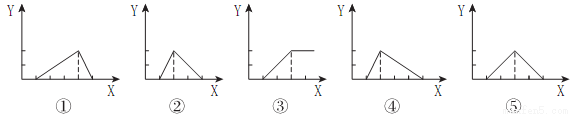
A.③②① B.③②④ C.③⑤① D.③⑤④
查看答案和解析>>
科目: 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:选择题
如图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是
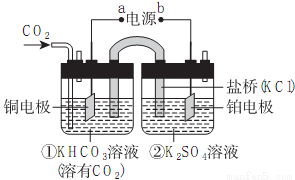
A.该过程是电能转化为化学能的过程
B.铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②池中溶液的pH一定升高
查看答案和解析>>
科目: 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:选择题
已知常温下Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5×10-13,下列有关说法错误的是
A.相同温度时,两种饱和溶液中:c(Cl-)≈19c(Br-)
B.AgCl、AgBr组成的混合溶液中:c(Cl-)>c(Br-)
C.向饱和AgCl溶液中通入HCl后有沉淀生成,但溶液中c(Cl-)增大
D.AgBr在水中溶解度及Ksp均比在NaBr溶液中的大
查看答案和解析>>
科目: 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z的原子序数依次递增,X与Y、Z位于相邻周期,X形成的常见含氧酸能氧化氢后金属,Y、Z原子最外层电子数之比为3:7,下列说法正确的是
A.X的常见氢化物水溶液显弱碱性
B.组成为HZO的物质结构式为H—Z—O
C.最高价氧化物对应水化物酸性:Z>X>Y
D.简单离子半径:Z>Y>X
查看答案和解析>>
科目: 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:填空题
1mol某烃A充分燃烧后可以得到8molCO2和4molH2O。该烃A在不同条件下能发生如图所示的一系列变化.

已知:①CH3—CH=CH2→+HBrCH3—CHBr—CH3
于CH3CH2Br+NaOH CH3CH2OH+NaBr
CH3CH2OH+NaBr
③CH3CH2Br+NaOH CH2=CH2+NaBr+H2O
CH2=CH2+NaBr+H2O
(1)A的化学式:___________。
(2)上述①~⑥反应中属于消去反应是___________(填序号)。
(3)写出C、D、E、物质的结构简式:C___________,D___________,E___________。
(4)写出B→E反应的化学方程式:___________。
查看答案和解析>>
科目: 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:推断题
A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图1所示的关系,完成下列空白:

(1)向酚酞试液中加入化合物A的粉末,现象为___________。
(2)单质甲与化合物B反应的离子方程式为___________。5.05g单质甲—钾合金溶于200mL水生成0.075mol氢气,确定该合金的化学式为___________。
(3)向20mL某浓度的化合物C的溶液中通人CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入0.1mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图2图示两种情况.
①由A确定滴加前60mL的盐酸时,发生反应的离子方程式为___________。
②由A图表明,原溶液通入CO2气体后,所得溶液中的溶质的化学式为___________。
③原化合物C溶液的物质的量浓度为___________。
④由A、B可知,两次实验通入的CO2的体积比为___________。
查看答案和解析>>
科目: 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:填空题
消除氮氧化物和硫氧化物有助于预防雾霾天气的形成。
(1)某恒容密闭容器中存在如下反应:C(s)+2NO(g)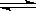 N2(g)+CO2(g)△H。维持温度不变,测得不同时刻几种气体物质的浓度如下表所示:
N2(g)+CO2(g)△H。维持温度不变,测得不同时刻几种气体物质的浓度如下表所示:
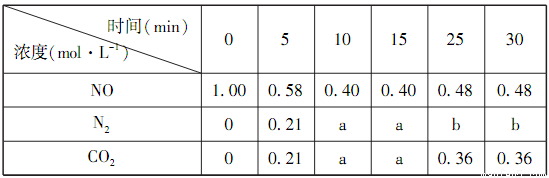
①0~10min内,NO的平均反应速率v(NO)=___________,该温度下反应的平衡常数K=___________。
②表中25min的数据变化与反应进行到22min时改变了反应体系中的某一条件有关,则b=___________,改变的条件可能是___________。
A.加入一定量的活性炭
B.通入一定量的N2
C.适当缩小容器的体积
③若15min时升高温度,达到平衡时容器中NO、N2、CO2的浓度之比为5:3:3,则△H___________0(填“>”、“=”或“<”)。
(2)NH3催化还原氮氧化物(产物是N2、H2O)是目前广泛采用的烟气脱氮技术
①当废气中NO2、NO的体积分数相等时脱氮率最高,若此情况下生成1molN2时反应放出的热量为akJ,则对应的热化学方程式为___________。
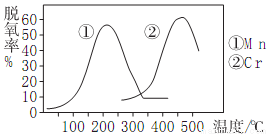
②右图使用不同催化剂时的脱氮率,则脱氮时最佳的温度、催化剂应是___________。
(3)用石灰浆作吸收剂也可脱去废气中的SO2,若处理结束时,测得吸收液中c(Ca2+)=0.70mol/L,则c(SO32-)=___________(已知Ksp(CaSO3)=1.4×10-7)。
查看答案和解析>>
科目: 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:填空题
锰是重要的过渡元素。
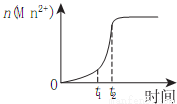
(1)已知常温下KMnO4溶液的pH=7,则0.01mol/LHMnO4溶液的pH=___________;研究表明,一定温度下将酸性KMnO4溶液与草酸溶液混合在一起后,溶液内n(Mn2+)随时间变化的情况如右图,则Mn2+物质的量在t1、t2时段内快速增加的原因可能是___________。
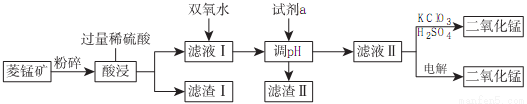
(2)工业上以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰有多种方法,下面是其中的一种生产流程示意图
常温下几种金属氢氧化物沉淀时的pH:
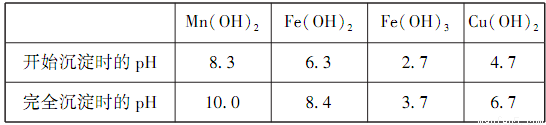
①滤渣Ⅱ的成分是___________,滤液I中反应的离子方程式为___________,
为确保除尽杂质而又不损失锰,pH的调整范围为___________。
②滤液Ⅱ中加入KClO3、H2SO4后反应的化学方程式为___________,用电解法制备MnO2时阳极上的电极反应式为___________。
(3)锰也是制备某些高能原电池的材料,某二次水溶液锂离子电池充电时,总反应方程式为LiMn2O=4Li1-xMn2O4+xLi。若电池的化学能转化为电能时的能量转化率为85%,则当消耗14g锂时,电路中转移的电子数目为___________NA。
查看答案和解析>>
科目: 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:填空题
某研究性学习小组的同学查阅资料得知:用无水醋酸钠与碱石灰混合加热可得到甲烷,他们欲利用右图装置(盛放排出B中饱和食盐水的装置省略了)完成氯气与甲烷的反应,请回答下列问题:
(1)A中的反应可表示为:CH3COONa+NaOH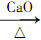 CH4+X(已配平),则X的成份是___________,装置C由两种仪器构成,它是贮气瓶(贮存有氯气),则P中贮存的物质是___________。
CH4+X(已配平),则X的成份是___________,装置C由两种仪器构成,它是贮气瓶(贮存有氯气),则P中贮存的物质是___________。
(2)实验过程中,在没有操作不当的情况下,试管底部往往也会出现裂痕,可能的原因是___________。
(3)集气瓶B是用于收集CH4、Cl2并使二者大约按照1:1的比例混合在一起,然后在光照条件下的反应。
①B内有一处需要改进,改正的方法是___________。
于判断进入B中的两种气体体积大约是1:1的方法是:___________。
(4)B中主要反应的化学方程式___________;用光可引发该反应,引发时应注意的问题是__________。
(5)确定B中的反应有HCl生成的方法是:取B中残留液与从B中排出的饱和食盐水少量相同体积分别放入X、Y两支试管中,然后__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com