
科目: 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:推断题
聚合物G可用于生产全生物降解塑料,在“白色污染”日益严重的今天有着重要的作用.有关转化关系如下:

已知:CH3CH2CH2Br→+NaOHCH3CH2CH2OH+NaBr,淀粉在硫酸催化下水解生成葡萄糖.
请回答下列问题:
(1)物质A的分子式为__________,B的结构简式为_____________。
(2)F中含氧官能团的名称________。
(3)反应①~④中属于加成反应的是________。
(4)写出由两分子F合成六元环化合物的化学方程式____________。
查看答案和解析>>
科目: 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:实验题
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:①反应C+G B+H能放出大量的热,G为红棕色;②I是一种常见的温室气体,它和E可以发生反应:2E+I
B+H能放出大量的热,G为红棕色;②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%。回答问题:
2F+D,F中的E元素的质量分数为60%。回答问题:
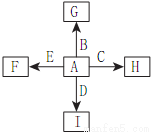
(1)①中反应的化学方程式为____________。
(2)1.6gG溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉_________克。
(3)C与过量NaOH溶液反应的离子方程式为________,反应后的溶液与过量的化合物I反应生成沉淀的离子方程式为____________。
(4)E与I反应的化学方程式为____________。
查看答案和解析>>
科目: 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:填空题
已知有关热化学方程式为:①4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H=-905kJ/mol;②3H2(g)+N2(g)
4NO(g)+6H2O(g)△H=-905kJ/mol;②3H2(g)+N2(g) 2NH3(g)△H=-92.4kJ/mol;③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;④N2(g)+O2(g)=2NO(g)△H=QkJ/mol;反应①中有关化学键的键能(kJ/mol)如下:H—O:463,H—N:391,O=O:497
2NH3(g)△H=-92.4kJ/mol;③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;④N2(g)+O2(g)=2NO(g)△H=QkJ/mol;反应①中有关化学键的键能(kJ/mol)如下:H—O:463,H—N:391,O=O:497
(1)①Q=___________。
②NO中的化学键键能为_________kJ/mol。
(2)向某密闭容器中充入amolNH3、bmolO2后,测得反应体系中某种量值X与压强P、温度T之间的变化如图1所示,图2表示温度为T2时,当容器为1L恒容密闭容器时,容器中NH3的平衡转化率与反应开始时两种反应物的投料之比(用M表示)的关系。
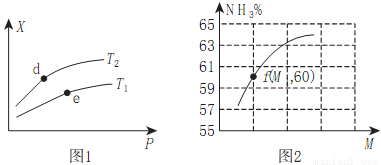
①若X表示NH3的百分含量,则T2_____T1(填>、<、无法确定);d、e两点的正反应的平衡常数K(d)_____K(e)。
②X还可以表示_____________。
A.混合气体的平均摩尔质量B.NO的产率C.△H值
③M=__________(用含a、b的式子表示,后同),若M1=1.25,则此时O2的转化率为__________%。
(3)有科学家电解原理获得高产率的合成氨,则阴极上的电极反应式为(已知电解质能传递H+)_______________。
查看答案和解析>>
科目: 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:填空题
氧元素能形成众多的化合物,其中有一些化合物具有特殊的组成与性质。
(1)H2O2、D2O、D2O2中化学性质彼此相似的物质是_________,OF2是一种棕黄色有恶臭的气体,有极强的氧化性,则OF2中氧元素的化合价为________,将F2通入稀的NaOH溶液中可得到OF2、盐等物质,相应反应的化学方程式为____________。
(2)研究表明,H2O2相当于二元弱酸,有较强的还原性
①H2O2的一级电离方程式为_________,已知常温下1L的H2O2相当于48.3mol,其一级电离平衡常数K约为1.67×10-12,则该温度下H2O2中c(H+)约为_________,写出它与足量Ba(OH)2反应的化学方程式________。
②过氧化氢、镁合金可构成镁燃料电池,放电时总反应:Mg+2H++H2O2=Mg2++2H2O,则放电时的正极反应为_________。
(3)氧也能与钾元素形成K2O、K2O2、KO2、KO3等氧化物,其中KO2是一种比Na2O2效率高的供氧剂,写出它与CO2反应的化学方程式_____________。
查看答案和解析>>
科目: 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:实验题
某研究性学习小组的同学通过查询资料知道,铁与浓度为1.15mol/L~1.25mol/L的硝酸反应时可同时得到NO2、NO、N2三种气体。他们欲利用下列仪器验证该结论的正确性(已知二氧化氮的沸点为21.1℃、熔点为-11℃,NO的沸点为-151℃、熔点为-164℃,假设实验过程中的每步转化均是完全的)。
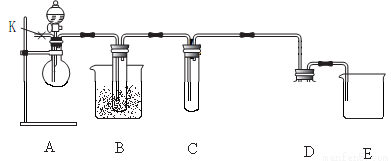
(1)实验时先通过K处导管向装置内通入CO2气体以排除装置内空气,目的是_____;若生成上述三种还原产物各0.02mol,则需要消耗铁的质量(硝酸足量)为_______g。
(2)B中冰盐水的作用是_________,证明有NO2生成的现象是_________。
(3)实验过程中,发现在B中产生预期现象的同时C中溶液的颜色慢慢变浅,则C中最可能发生的反应的离子方程式是_________;装置D、E是用于(排液法)收集N2,请完善装置D(在原图中进行)。
(4)将等物质的量的NO2、NO通入冰冻的水中二者恰好反应并得到一种酸X,则X的化学式为_________。有同学认为,不能根据X与Na2SO3溶液反应的情况比较X的酸性与亚硫酸的酸性的相对强弱,该同学的理由是__________。
查看答案和解析>>
科目: 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色
B.有机物 的消去(分子内脱水)产物只有1种
的消去(分子内脱水)产物只有1种
C.有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH—COOCH3
D.可用溴水鉴别已烯、四氯化碳和乙酸
查看答案和解析>>
科目: 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:实验题
水杨酸是一种用途极广的消毒防腐剂及医疗保养品,是合成众多药物的中间产物,其工业合成的路线之一如下图所示:

已知:RCH=CHR1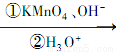 RCOOH+R1COOH
RCOOH+R1COOH
请回答下列问题:
(1)B分子中含氧官能团的名称为_________,D→水杨酸的反应类型为_________。
(2)C转化为D的同时还有一种有机物生成,该物质的结构简式为__________,上述转化过程中B→C的意义是_________;在适当条件下,水杨酸可发生聚合反应生成一种高分子化合物,该化合物的结构简式为__________。
(3)A→B的化学方程式_________。
(4)D有多种同分异构体,符合下列条件的同分异构体最多有_________种,写出核磁共振氢谱有4个峰的物质的结构简式____________。
①是苯的二元取代物;②能发生水解反应及银镜反应
(5)以1,4-二氯丁烷为基本原料制备乙二酸,写出相应的合成路线图(格式为反应物 生成物)
生成物)
查看答案和解析>>
科目: 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:选择题
N2的结构可以表示为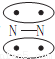 ,CO的结构可以表示为
,CO的结构可以表示为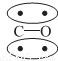 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )
A.N2分子与CO分子中都含有叁键
B.CO分子中有一个π键是配位键
C.N2、CO分别由非极性键和极性键结合,因此二者不是等电子体
D.N2与CO的化学性质相同
查看答案和解析>>
科目: 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:填空题
X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:
(1)基态M2+的电子排布式为__________,X、Y、Z、M的电负性由大到小的顺序为__________。
(2)化合物XCl3的中心原子杂化类型为__________;YCl3的立体构型为__________,XCl3、YCl3分子中属于非极性分子的是__________。
(3)H2Z、H2Z2、H2R的沸点分别为100℃、158℃,-60.4℃,试解释此种现象____________。
(4)H2RO3的K1和K2分别为1.54×10-2和1.02×10-7,熔融化状态下RO3不能导电而Na2O能导电,请根据结构与性质的关系解释下列问题:
①K1>K2:____________。
②RO3不能导电而Na2O能导电:____________。
(5)Z、M形成的一种化合物晶胞如图所示: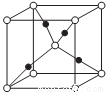 (实心球代表M)
(实心球代表M)
①该化合物的化学式为_______________。
②若晶胞参数为apm。列式计算该晶胞的密度籽=____g·cm-3。
查看答案和解析>>
科目: 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:选择题
根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
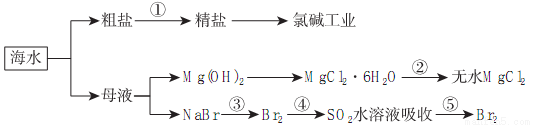
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程④中SO2被氧化
C.从第③步到第⑤步的目的是为了浓缩
D.从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com