
科目: 来源:2016年全国普通高等学校招生统一考试化学(上海卷精编版) 题型:填空题
NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为____________(选填“酸性”、“碱性”或“中性”);原因是______________________。
(2)写出第二次氧化时发生反应的离子方程式。
_______________________________________
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________、__________和H2O。
(5)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是___________;H、C、N、O、Na的原子半径从小到大的顺序为_______。
(6)HCN是直线型分子,HCN是___________分子(选填“极性”、“非极性”)。HClO的电子式为___________。
查看答案和解析>>
科目: 来源:2016年全国普通高等学校招生统一考试化学(上海卷精编版) 题型:填空题
随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)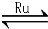 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]
D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3- H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
____________________________________________________________________________________
查看答案和解析>>
科目: 来源:2016年全国普通高等学校招生统一考试化学(上海卷精编版) 题型:实验题
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。

完成下列填空:
(1)实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________;浓硫酸用量又不能过多,原因是____________。
(2)饱和Na2CO3溶液的作用是___________、_____________、_____________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯粗产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
查看答案和解析>>
科目: 来源:2016年全国普通高等学校招生统一考试化学(上海卷精编版) 题型:实验题
半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
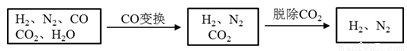
完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O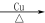 CO2+H2
CO2+H2
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
Na2CO3 | K2CO3 | |
20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
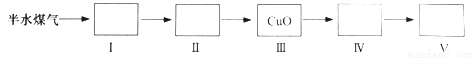
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②该实验方案中,步骤Ⅰ、Ⅱ的目的是:_________________。
③该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
查看答案和解析>>
科目: 来源:2016年全国普通高等学校招生统一考试化学(上海卷精编版) 题型:推断题
异戊二烯是重要的有机化工原料,其结构简式为CH2=C(CH3)CH=CH2。
完成下列填空:
(1)化合物X与异戊二烯具有相同的分子式,与Br2/CCl4反应后得到3-甲基-1,1,2,2-四溴丁烷。X的结构简式为_______________。
(2)异戊二烯的一种制备方法如下图所示:
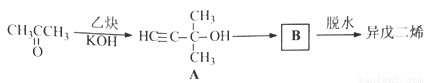
A能发生的反应有___________。(填反应类型)
B的结构简式为______________。
(3)设计一条由异戊二烯制得有机合成中间体 的合成路线。
的合成路线。
(合成路线常用的表示方式为: )
)
查看答案和解析>>
科目: 来源:2016年全国普通高等学校招生统一考试化学(上海卷精编版) 题型:推断题
M是聚合物胶黏剂、涂料等的单体,其一条合成路线如下(部分试剂及反应条件省略):
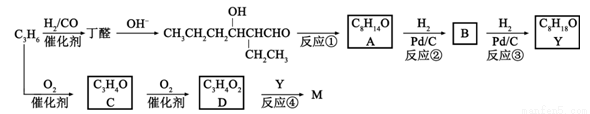
完成下列填空:
(1)反应①的反应类型是____________。反应④的反应条件是_____________。
(2)除催化氧化法外,由A得到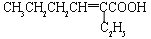 所需试剂为___________。
所需试剂为___________。
(3)已知B能发生银镜反应。由反应②、反应③说明:在该条件下,_______________。
(4)写出结构简式。C________________ M________________
(5)D与1-丁醇反应的产物与氯乙烯共聚可提高聚合物性能,写出该共聚物的结构简式。_____________
(6)写出一种满足下列条件的丁醛的同分异构体的结构简式。____________
①不含羰基②含有3种不同化学环境的氢原子
已知:双键碳上连有羟基的结构不稳定。
查看答案和解析>>
科目: 来源:2016年全国普通高等学校招生统一考试化学(上海卷精编版) 题型:简答题
CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O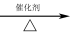 CO+3H2
CO+3H2
已知:CO+2H2 CH3OH CO2+3H2
CH3OH CO2+3H2 CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
查看答案和解析>>
科目: 来源:2016年全国普通高等学校招生统一考试化学(四川卷精编版) 题型:选择题
化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A.氯气作水杀菌消毒剂
B.硅胶作袋装食品的干燥剂
C.二氧化硫作纸浆的漂白剂
D.肥皂水作蚊虫叮咬处的清洗剂
查看答案和解析>>
科目: 来源:2016年全国普通高等学校招生统一考试化学(四川卷精编版) 题型:选择题
根据下列实验操作和现象得出的结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
B | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
C | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加KIO3 |
D | 向苯酚钠溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比苯酚强 |
查看答案和解析>>
科目: 来源:2016年全国普通高等学校招生统一考试化学(四川卷精编版) 题型:选择题
下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com