
科目: 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:选择题
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)  2G(g),忽略固体体积,平衡时G的体积分数(%)的温度和压强的变化如下表所示。
2G(g),忽略固体体积,平衡时G的体积分数(%)的温度和压强的变化如下表所示。
1.0MPa | 2.0MPa | 3.0MPa | |
810℃ | 54.0% | a | b |
915℃ | c | 75.0% | d |
1000℃ | e | f | 83.0% |
①b<f;②915℃,2.0MPa时E的转化率为60%;③该反应的∆S>0;④K(1000℃)>K(810℃)。
上述①~④中正确的有( )
A.1个 B.2个 C.3个 D.4个
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是( )
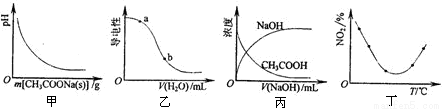
A.图甲表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
B.图乙表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容容量中,不同温度下分别发生反应,2NO2(g)  N2O4(g),相同时间后测得NO2含量的曲线,则反应的∆H<0
N2O4(g),相同时间后测得NO2含量的曲线,则反应的∆H<0
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:选择题
下列关于盐类水解的说法错误的是( )
A.pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:③>②>①
B.浓度均为0.1mol/L的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:①>②>③
C.在NH4Cl溶液中加入稀HNO3,能抑制NH4+水解
D.在CH3COONa溶液中加入冰醋酸,能控制CH3COO-水解
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:选择题
pH=2的两种一元酸HX和HY的溶液分别是50mL,加入过量的镁粉,充分反应后,收集H2的体积在相同状况下分别为V1和V2,若V1>V2,下列说法不正确的是( )
A.HX一定是弱酸
B.同浓度的NaX水溶液的碱性强于NaY水溶液的碱性
C.HX一定是强酸
D.反应过程中二者生成H2的速率不相同
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:选择题
部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | 1.77×10-4 | 4.9×10-16 | K1=4.3×10-7 K2=5.6×10-11 |
下列选项错误的是( )
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.HCOOH+CN-=HCOO-+HCN
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:选择题
T K时,向2L恒容密闭容器中充入1molCOCl2,发生反应COCl2(g)  Cl2(g)+CO(g),经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/% | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前2s的平均速率v(CO)=0.080mol/L/s
B.保持其他条件不变,升高温度,平衡时c(Cl2)=0.11mol/L
C.T K时起始向容器中充入0.9molCOCl2、0.10molCO,反应达到平衡前v(正)>v(逆)
D.T K时起始向容器中充入1.0molCl2和0.9molCO。达到平衡时,Cl2的转化率大于80%
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:实验题
I.为了探究外界条件对H2O2分解速率的影响,有同学利用实验室提供的仪器和试剂进行了如下实验,请填写下列空白:
试剂:5%H2O2溶液,10%H2O2溶液,1mol/LFeCl3溶液,MnO2粉末
仪器:试管、胶头滴管、酒精灯
(1)实验目的:探究温度对化学反应速率的影响
实验步骤:分别对A、B两支试管中加入5mL 5%H2O2溶液,将试管A放入5℃水浴中,将试管B放入40℃水浴中,同时分别向两试管中加入2~3滴1mol/LFeCl3溶液。观察实验现象。
实验现象:试管________(填“A”或“B”)中产生气泡的速率快,说明___________。
(2)实验目的:探究浓度对化学反应速率的影响
实验步骤:向试管A中加入5mL 5%H2O2溶液,向试管B中加入5mL 10%H2O2溶液,观察实验现象。
实验现象:试管A、B中均有少量气体缓慢产生。
请你改进实验方案,使该实验的实验现象更为明显,以支撑“浓度改变会影响化学反应速率”这一理论预测,___________________________。
(3)实验目的:________________________。
实验步骤:分别向试管A和B中加入5mL 5%H2O2溶液后,再向试管B中加入1mL 1mol/L的FeCl3溶液,观察实验现象。
你认为方案(3)的设计是否严谨?_________(填是或否),说明理由_________________。
II.请设计“以镁与不同浓度稀硫酸反应探究浓度对化学反应速率影响”的实验方案。
实验中可供选择的试剂与用品:镁带(密度1.74g/cm、宽度0.5cm、厚度0.05cm)、砂纸、剪刀、1.0mol/L的硫酸、蒸馏水、恒温水浴箱、试管、量筒、秒表。实验方案:_____________________________________。
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:填空题
(1)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11,则该温度下水的KW=_______。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va:Vb=___________。
(2)25℃时,0.1mol/L的HaA溶液中c(H+)/c(OH-)=1010,请回答下列问题:
①HaA是___________(填“强电解质”或“弱电解质”)。
②在加水稀释HaA溶液的过程中,随着水量的增加而增大的是__________(填字母)
A.c(HaA) B.c(H+)/c(HaA) C.c(H+)与c(OH-)的乘积 D.c(OH-)
③NanA溶液显__________(填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)____________。
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:填空题
某市对大气进行检测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃烧、机动车尾气等。因此,对PM2.5、SO2、NO等进行研究具有重要意义。回答下列问题:
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ∆H=-890.3KJ/mol
②N2(g)+O2(g)=2NO(g) ∆H=+180KJ/mol
CH4可用于燃烧脱硝,CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ∆H=_______________。
(2)汽车尾气中NOx和CO的生成及转化
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) ∆H>0。汽车启动后,气缸温度较高,单位时间内NO排放量越大,原因是_______________________。
2NO(g) ∆H>0。汽车启动后,气缸温度较高,单位时间内NO排放量越大,原因是_______________________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)已知反应的∆H>0,简述该设想能否实现的依据_______________________。
③目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其化学方程式为_______________。
(3)一定温度下,在密闭容器中反应2NO2(g)  N2O4(g) ∆H=-57.20KJ/mol达到平衡。其他条件不变时,下列措施能提高NO2转化率的是____________(填字母)
N2O4(g) ∆H=-57.20KJ/mol达到平衡。其他条件不变时,下列措施能提高NO2转化率的是____________(填字母)
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
在一定温度和压强下,密闭容器中N2O4和NO2的混合气体达到平衡时,c(N2O4)=0.0120mol/L(已知2NO2(g)  N2O4(g)反应在该温度下的平衡常数K=40/3)。计算平衡时 NO2物质的量浓度为________________。
N2O4(g)反应在该温度下的平衡常数K=40/3)。计算平衡时 NO2物质的量浓度为________________。
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:实验题
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4 •xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:学习小组的同学设计了滴定的方法测定x值.
①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀硫酸.
③用浓度为0.1000mol/L的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00mL.
回答下列问题:
(1)配平氧化还原反应方程式:___H2C2O4+___MnO4-+___H+=____CO2↑+Mn2++___H2O
(2)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。

(3)本实验滴定达到终点的标志是______________________。
(4)通过上述数据,求x的值(写出计算过程)。
(5)误差分析:
①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com