
科目: 来源:2015-2016学年福建省厦门市高一下学期期末化学试卷(解析版) 题型:选择题
已知反应①:CO(g)+CuO(s) 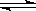 CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)?
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)?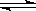 ?Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2该温度下反应③:CO(g)+H2O(g)
?Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2该温度下反应③:CO(g)+H2O(g) 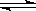 CO2(g)+H2(g)的平衡常数为K则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K则下列说法正确的是( )
A.反应①的平衡常数K1=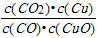
B.反应③的平衡常数K=
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目: 来源:2015-2016学年福建省厦门市高一下学期期末化学试卷(解析版) 题型:选择题
某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A + 3B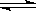 2C,若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中C气体的体积占10%,下列推断正确的是( )
2C,若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中C气体的体积占10%,下列推断正确的是( )
①原混合气体的体积为1.2VL
②原混合气体的体积为1.1VL
③反应达平衡时,气体A消耗掉0.05VL
④反应达平衡时,气体B消耗掉0.05V L
A、②③ B、②④ C、①③ D、①④
查看答案和解析>>
科目: 来源:2015-2016学年福建省厦门市高一下学期期末化学试卷(解析版) 题型:选择题
将1mol N2O5置于2L密闭容器中,在一定温度下发生下列反应:
①2N2O5(g)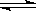 2N2O4 (g)+O2 (g); ②N2O4(g)
2N2O4 (g)+O2 (g); ②N2O4(g)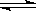 2NO2 (g) 达到平衡时,
2NO2 (g) 达到平衡时,
c(O2)=0.2 mol·L-1,c(NO2)=0.6mol·L-1,则此温度下反应①的平衡常数为( )
A.3.2 B.0.2 C.1/180 D.4/45
查看答案和解析>>
科目: 来源:2015-2016学年福建省厦门市高一下学期期末化学试卷(解析版) 题型:选择题
在恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个带有理想活塞(即无质量、无摩擦力的刚性活塞)的体积可变的密闭容器,两容器起始状态完全相同,都充有C气体,若发生可逆反应C(g) 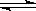 A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡.下列说法中正确的是( )
A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡.下列说法中正确的是( )
A. 反应速率:乙>甲
B.平衡时C的体积分数:乙>甲
C.平衡时C的转化率:乙>甲
D.平衡时A的物质的量:甲>乙
查看答案和解析>>
科目: 来源:2015-2016学年福建省厦门市高一下学期期末化学试卷(解析版) 题型:选择题
己知反应A(g)+B(g)  C(g)+D(g)的平衡常数K值与温度的关系如下表所示.830℃时,向一个2L的密闭容器中充入0.20molA和0.80molB,4s内v(A)=0.005 mol·L-1·S-1.
C(g)+D(g)的平衡常数K值与温度的关系如下表所示.830℃时,向一个2L的密闭容器中充入0.20molA和0.80molB,4s内v(A)=0.005 mol·L-1·S-1.
下列说法正确的是( )
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A.4s时,c(B)为0.76 mol·L-1
B. 830℃到平衡时,A的转化率为80%
C. 达平衡时,升高温度,平衡正向移动
D.1200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4
查看答案和解析>>
科目: 来源:2015-2016学年福建省厦门市高一下学期期末化学试卷(解析版) 题型:选择题
2SO2(g)+O2(g) 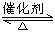 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示:
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率/% | 80 | α1 | α2 | |
下列判断中,正确的是( )
A.甲中反应的平衡常数小于乙
B.该温度下,平衡常数值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
科目: 来源:2015-2016学年福建省厦门市高一下学期期末化学试卷(解析版) 题型:选择题
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) 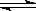 CO2+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1) :
CO2+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1) :
反应时间/min | n(CO)/mol | H2O/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为ν(H2)=0.40/t1 mol·L-1·min-1
B. 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
C.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.40mol
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目: 来源:2015-2016学年福建省厦门市高一下学期期末化学试卷(解析版) 题型:填空题
Ⅰ.从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平.B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78.回答下列问题:
(1)A的电子式 B的结构简式
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式: ,反应类型: ;
(3)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式: ,反应类型: ;
Ⅱ.(1)某烃A的蒸气密度是同条件下氢气密度的64倍,则 A的分子式可能为 ,若A中含有6个甲基,但不可能是烯烃与氢气的加成产物,则A的结构简式 ;
(2)已知1mol烃B中所含电子总数为42NA,且C、H两种元素的质量比为5:1,则其分子式为 ,在它的同分异构体中,一氯代物只有一种的是 (写结构简式)。
查看答案和解析>>
科目: 来源:2015-2016学年福建省厦门市高一下学期期末化学试卷(解析版) 题型:简答题
高炉炼铁过程中发生的主要反应为 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0,(填>、<或 =);
(2)欲提高反应中CO的平衡转化率,可采取的措施是 ;
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.加入合适的催化剂
E.增大容器的容积
F.提高反应温度
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,此时V(正) V(逆)(填“>”“<”或“=”),若反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v (CO2)= CO的平衡转化率= .
查看答案和解析>>
科目: 来源:2015-2016学年福建省厦门市高一下学期期末化学试卷(解析版) 题型:简答题
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)  2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g)  2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g)  SO3(g)+NO(g)的ΔH= kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
(2)一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K=
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH 0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是: 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH 0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是: 。
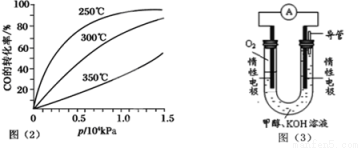
(4)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
①该电池工作时,OH-向 极移动(填“正”或“负”)。
②该电池正极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com