
科目: 来源:2015-2016学年内蒙古高一6月月考化学试卷(解析版) 题型:填空题
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
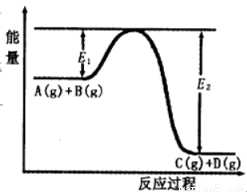
(1)该反应是______反应(填“吸热”“放热”);
(2)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1______,E2______(填“增大”“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?______,(填“是”或“否”)原因是_______________。
(4)该反应的反应热△H=__________kJ/mol。(用E1和E2表示)
查看答案和解析>>
科目: 来源:2015-2016学年内蒙古高一6月月考化学试卷(解析版) 题型:简答题
短周期原子序数依次递增的A、B、C、D、E、F六种元素,已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;C原子内层电子总数是最外层电子数10倍;A、B、D三种元素的原子最外层电子数之和为13;A和B原子最外层电子数之和与D和F原子最外层电子数之和相等;D和E是相邻两种元素。回答下列问题:
(1)E元素的名称: ;其在元素周期表中的位置是 。
(2)AB2的结构式 ;B的氢化物中原子个数比1:1化合物的电子式 。
(3)A和E元素的最高价含氧酸的酸性较强的是 ;(填化学式)
(4)B、C、D、F四种元素原子半径由大到小的顺序是 (填元素符号),离子半径最小的是 (填离子符号)。
(5)A、B、C三种元素组成原子个数比为nA:nB:nC=1:3:2的化合物,将足量AB2通入该化合物溶液中反应的离子方程式是 。
(6)短周期元素M与D元素位于不同主族,根据对角线规则二者某些性质相似。将M的最高价氧化物溶于C的最高价氧化物对应的水化物溶液中,发生反应的离子方程式为 。
(7)E和F形成的化合物X在高温条件下可以被氢气还原,工业上常用此反应制取高纯度的单质E,写出该化学反应的方程式 。
查看答案和解析>>
科目: 来源:2015-2016学年内蒙古高一6月月考化学试卷(解析版) 题型:实验题
某学生通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________________;由图可知该装置有不妥之处,应如何改正? 。
(2)实验中改用60 mL0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”);所求中和热的数值会______________(填“相等”或 “不相等”),理由是_____________________________。
(3)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视计数
E.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
(4)将V1ml 1.0mol/L HCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)
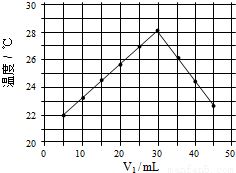
通过分析图像可知,做该实验时环境温度 (填“高于”,“低于”或“等于”)22℃,该NaOH溶液的浓度约为 mol/L。
查看答案和解析>>
科目: 来源:2015-2016学年内蒙古高一6月月考化学试卷(解析版) 题型:填空题
工业合成氨反应的化学方程式为:N2(g)+3H2(g)  2NH3(g) △=-92.3kJ/mol。一定温度下,向体积为2L的密闭容器中加入1mol N2和3mol H2,经2min后达到平衡,平衡时测得NH3的浓度为0.5 mol/L。
2NH3(g) △=-92.3kJ/mol。一定温度下,向体积为2L的密闭容器中加入1mol N2和3mol H2,经2min后达到平衡,平衡时测得NH3的浓度为0.5 mol/L。
(1)2min 内H2的反应速率v(H2)= ;
(2)充分反应并达到平衡时,放出的热量 92.3kJ(填“大于”、“小于”或“等于”)。
原因是 。
(3)下列说法可证明反应达到平衡状态的 。
A.单位时间内,断开1mol N≡N,同时断开3mol H—H
B.单位时间内,形成1mol N≡N,同时形成3mol N—H
C.单位时间内,断开1mol N≡N,同时断开6mol N—H
D.单位时间内,形成1mol N≡N,同时断开3mol H—H
(4)氨的一个重要用途是用于制备火箭发射原料N2H4(肼),已知:火箭发射的原理是N2H4(肼)在NO2中燃烧,生成N2、水蒸气。根据如下反应:
N2(g)+2O2(g)=2NO2(g) △H1=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-534.0kJ/mol
写出在相同状态下,发射火箭反应的热化学方程式 。
查看答案和解析>>
科目: 来源:2015-2016学年内蒙古高一6月月考化学试卷(解析版) 题型:填空题
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学方程式为___ ___。利用反应6NO2+8NH3=7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+O2(g)  2SO3(g) △H= -196.6kJ/mol
2SO3(g) △H= -196.6kJ/mol
2NO(g)+O2(g)  2NO2(g) △H= -113.0kJ/mol
2NO2(g) △H= -113.0kJ/mol
则反应NO2(g)+SO2(g) =SO3(g)+NO(g)的△H=______kJ/mol。
(3)如下图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2(g)+O2(g)  2SO3(g)的反应。问:
2SO3(g)的反应。问:
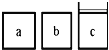
①起始a、c两容器的反应速率大小关系为Va_____Vc;(填“>”“<”或“=”下同)
②反应一段时间后a、c中速率大小关系为Va_____Vc;
③如起始在a、c两容器中通入等量的He,则此时三容器起始压强为Pa_____Pb_____Pc;起始反应速率关系为Va_____Vb_____Vc。
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
化学与生产、生活、环境等密切相关。下列说法正确的是
A.开发氟氯代烷制冷剂,有利于保护臭氧层
B.绿色食品就是不使用农药,不含任何化学物质的食品
C.推广使用煤液化技术,可减少二氧化碳温室气体的排放
D.使用可降解的无毒聚乳酸塑料代替乙烯作食品包装袋,可减少白色污染
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
下列化学用语表示正确的是
A.甲基的电子式: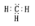
B.CH4分子的球棍模型:
C.(CH3)2C=CH2的命名:1-甲基-2-丙烯
D.甲醛的结构式: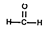
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
下列说法正确的是
A.温度越高,酶对某些反应的催化效率越高
B.重金属盐使蛋白质变性,误食硫酸铜可立即吞服牛奶
C.甲烷、汽油、酒精都是碳氢化合物,都可作燃料
D.石油裂解和油脂皂化都是由高分子生成小分子的过程
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
下列实验可达到实验目的的是
A.用酸性KMnO4溶液可除去乙烷中混有的乙烯
B.向CH3CH2Br中滴入AgNO3溶液以检验溴元素
C.通过红外光谱分析可以区分乙酸和甲酸甲酯
D.乙酰水杨酸(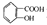 )与适量NaOH溶液反应制备(
)与适量NaOH溶液反应制备(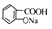 )
)
查看答案和解析>>
科目: 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
下列有关物质的性质、制取或应用等说法正确的是
A.乙烯能发生加成反应,可用于合成塑料
B.在工业上,通过分馏石油可得到甲烷、乙烯、苯
C.实验室用苯和溴水混合,并加铁粉制取溴苯
D.可利用丁达尔效应来区别葡萄糖和蔗糖溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com